题目内容
已知A、B、C、D、E五种有机化合物均为烷烃,请回答下列问题:
(1)若 A的分子中含有24个氢原子,则A的分子式为 ;
(2)若B的相对分子质量为100,B的分子主链上有5个碳原子,且分子中有3个甲基,则B的结构简式为: ;
(3)若C的分子式为C8H18,且C的一元取代产物只有一种,则C的结构简式为 ;
(4)已知烯烃X的分子式为C6H12,该分子中所有碳原子在同一平面,X与氢气发生加成反应生成D,则D的分子式为 ,X的结构简式为 .
(5)已知1molE在氧气中充分燃烧,消耗5mol氧气,写出E的结构简式 .
(1)若 A的分子中含有24个氢原子,则A的分子式为
(2)若B的相对分子质量为100,B的分子主链上有5个碳原子,且分子中有3个甲基,则B的结构简式为:
(3)若C的分子式为C8H18,且C的一元取代产物只有一种,则C的结构简式为
(4)已知烯烃X的分子式为C6H12,该分子中所有碳原子在同一平面,X与氢气发生加成反应生成D,则D的分子式为
(5)已知1molE在氧气中充分燃烧,消耗5mol氧气,写出E的结构简式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:A、B、C、D、E五种有机化合物均为烷烃,
(1)若 A的分子中含有24个氢原子,烷烃通式为CnH 2n+2,2n+2=24,则n=11,从而确定A分子式;
(2)烷烃通式为CnH 2n+2,若B的相对分子质量为100,则n=
=7,B的分子主链上有5个碳原子,且分子中有3个甲基,说明该分子中的一个C原子上含有3个乙基,B为3-乙基戊烷,据此书写B的结构简式;
(3)若C的分子式为C8H18,且C的一元取代产物只有一种,则C是2,2,3,3-四甲基丁烷;
(4)烯烃X的分子式为C6H12,该分子中所以碳原子在同一平面,说明连接碳碳双键的每个C原子上连接2个甲基,X与氢气发生加成反应生成D,D为2,3-二甲基丁烷;
(5)烷烃通式为CnH 2n+2,1molE在氧气中充分燃烧,消耗氧气的物质的量=(n+
)mol=5mol,n=3,则该物质为丙烷.
(1)若 A的分子中含有24个氢原子,烷烃通式为CnH 2n+2,2n+2=24,则n=11,从而确定A分子式;
(2)烷烃通式为CnH 2n+2,若B的相对分子质量为100,则n=
| 100-2 |
| 14 |
(3)若C的分子式为C8H18,且C的一元取代产物只有一种,则C是2,2,3,3-四甲基丁烷;
(4)烯烃X的分子式为C6H12,该分子中所以碳原子在同一平面,说明连接碳碳双键的每个C原子上连接2个甲基,X与氢气发生加成反应生成D,D为2,3-二甲基丁烷;
(5)烷烃通式为CnH 2n+2,1molE在氧气中充分燃烧,消耗氧气的物质的量=(n+
| 2n+2 |
| 4 |
解答:
解:A、B、C、D、E五种有机化合物均为烷烃,
(1)若 A的分子中含有24个氢原子,烷烃通式为CnH 2n+2,2n+2=24,则n=11,则A分子式为C11H24,故答案为:C11H24;
(2)烷烃通式为CnH 2n+2,若B的相对分子质量为100,则n=
=7,B的分子主链上有5个碳原子,且分子中有3个甲基,说明该分子中的一个C原子上含有3个乙基,B为3-乙基戊烷,则B的结构简式为(CH3CH2)3CH,故答案为:(CH3CH2)3CH;
(3)若C的分子式为C8H18,且C的一元取代产物只有一种,则C是2,2,3,3-四甲基丁烷,则C的结构简式为(CH3)3CC(CH3)3,故答案为:(CH3)3CC(CH3)3;
(4)烯烃X的分子式为C6H12,该分子中所以碳原子在同一平面,说明连接碳碳双键的每个C原子上连接2个甲基,X与氢气发生加成反应生成D,D为2,3-二甲基丁烷,D分子式为C6H14,X结构简式为(CH3)2C=C(CH3)2,
故答案为:C6H14;(CH3)2C=C(CH3)2;
(5)烷烃通式为CnH 2n+2,1molE在氧气中充分燃烧,消耗氧气的物质的量=(n+
)mol=5mol,n=3,则该物质为丙烷,其结构简式为CH3CH2CH3,故答案为:CH3CH2CH3.
(1)若 A的分子中含有24个氢原子,烷烃通式为CnH 2n+2,2n+2=24,则n=11,则A分子式为C11H24,故答案为:C11H24;
(2)烷烃通式为CnH 2n+2,若B的相对分子质量为100,则n=
| 100-2 |
| 14 |
(3)若C的分子式为C8H18,且C的一元取代产物只有一种,则C是2,2,3,3-四甲基丁烷,则C的结构简式为(CH3)3CC(CH3)3,故答案为:(CH3)3CC(CH3)3;
(4)烯烃X的分子式为C6H12,该分子中所以碳原子在同一平面,说明连接碳碳双键的每个C原子上连接2个甲基,X与氢气发生加成反应生成D,D为2,3-二甲基丁烷,D分子式为C6H14,X结构简式为(CH3)2C=C(CH3)2,
故答案为:C6H14;(CH3)2C=C(CH3)2;
(5)烷烃通式为CnH 2n+2,1molE在氧气中充分燃烧,消耗氧气的物质的量=(n+
| 2n+2 |
| 4 |
点评:本题考查有机物推断,侧重考查有机物结构简式的书写,明确有机物结构是解本题关键,会根据通式、方程式、物质结构进行推断,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
 X、Y、Z、W有如图所示的转化关系,则X、W可能是( )
X、Y、Z、W有如图所示的转化关系,则X、W可能是( )①AlCl3、NaOH ②C、O2 ③Cl2、Fe ④S、O2.
| A、①②③ | B、①② |
| C、③④ | D、①②③④ |
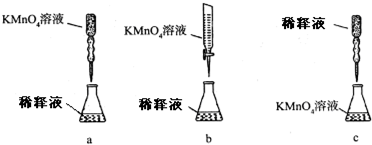
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: