题目内容
19.用一种试剂除去下列物质中的杂质(括号内的物质是杂质),写出所用试剂及对应反应的离子方程式.(1)Na2SO4(Na2CO3):试剂为硫酸;
(2)Cu(Fe):试剂为盐酸(或稀硫酸);离子方程式为Fe+2H+═Fe2++H2↑.
分析 (1)碳酸钠与硫酸反应生成硫酸钠和水、二氧化碳;
(2)Fe与盐酸反应,而Cu不能.
解答 解:(1)碳酸钠与硫酸反应生成硫酸钠和水、二氧化碳,则除杂试剂为硫酸,离子反应为CO32-+2H+═CO2↑+H2O,故答案为:硫酸;
(2)Fe与盐酸反应,而Cu不能,则除杂试剂为盐酸(或稀硫酸),离子反应为Fe+2H+═Fe2++H2↑,故答案为:盐酸(或稀硫酸);Fe+2H+═Fe2++H2↑.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
9.下列反应既属于氧化还原反应,又属于置换反应的是( )
| A. | 2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | CaO+CO2═CaCO3 | D. | 2H2O+2Na═2NaOH+H2↑ |
10.将25.6克的铜完全溶于适量的浓硝酸中,收集到氮的氧化物(NO2、N2O4、NO)的混合气,这些混合气恰好能被250ml 2mol/L NaOH溶液完全吸收,生成NaNO2和NaNO3的盐溶液,则其中NaNO3的物质的量为( )
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3mol | D. | 0.4 mol |
14.将一滴汞滴在已除去表面氧化膜的铝片上,放置在空气中等待片刻,滴有汞的地方会较快地长出“白毛”.关于该实验说法错误的是( )
| A. | “白毛”的主要咸分是氧化铝 | |
| B. | 在长出“白毛”过程中,铝片的温度会升高 | |
| C. | 若用硝酸汞溶液代替汞就无法看到类似的现象 | |
| D. | 此过程中涉及到的化学变化与原电池的原理有关 |
4.下列实验所对应的装置或所选用的物品都准确的是( )
| A. | 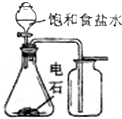 实验室制备并收集乙炔 | B. | 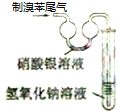 证明溴苯中含溴元素 | ||
| C. | 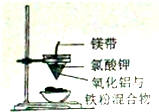 铝热反应 | D. | 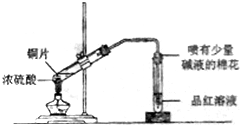 检测铜与浓硫酸反应的气体产物 |
 (1)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应,生成Na2HPO3,电解Na2HPO3溶液可得到亚磷酸,装置示意图如下:
(1)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应,生成Na2HPO3,电解Na2HPO3溶液可得到亚磷酸,装置示意图如下:
 .
.