题目内容
下列说法正确的是( )
| A、32gO2占有的体积约为22.4L | ||
B、a L甲烷和乙烷混合气体中的分子数约为
| ||
| C、在标准状况下,22.4L水的质量约为18g | ||
| D、22g二氧化碳与标准状况下的11.2L HCl含有相同的分子数 |
考点:气体摩尔体积
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氧气所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol;
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol;
C.标况下水为液态,不能用气体摩尔体积计算其物质的量;
D.根据n=
=
计算二氧化碳、HCl物质的量,再由N=nNA判断.
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol;
C.标况下水为液态,不能用气体摩尔体积计算其物质的量;
D.根据n=
| m |
| M |
| V |
| Vm |
解答:
解:A.32gO2的物质的量为1mol,氧气所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol,所占用的体积不一定是22.4L,故A错误;
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol,a L甲烷和乙烷混合气体中的物质的量不一定是
mol,故B错误;
C.标况下水为液态,不能用气体摩尔体积计算其物质的量,22.4L水的质量远远大于18g,故C错误;
D.22g二氧化碳的物质的量=
=0.5mol,标准状况下的11.2L HCl的物质的量=
=0.5mol,二者物质的量相等,由N=nNA可知,二者含有分子数目相等,故D正确,
故选D.
B.混合气体所处的状态不一定是标准状况,气体摩尔体积不一定是22.4L/mol,a L甲烷和乙烷混合气体中的物质的量不一定是
| a |
| 22.4 |
C.标况下水为液态,不能用气体摩尔体积计算其物质的量,22.4L水的质量远远大于18g,故C错误;
D.22g二氧化碳的物质的量=
| 22g |
| 44g/mol |
| 11.2L |
| 22.4L/mol |
故选D.
点评:本题考查气体摩尔体积,难度不大,注意气体摩尔体积的使用条件及对象.

练习册系列答案
相关题目
1g O2和1g O3相比,下列表述正确的是( )
| A、所含分子数相同 |
| B、所含原子数相同 |
| C、所含原子数不同 |
| D、1g O3中所含分子数较多 |
下列说法正确的是( )
| A、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| B、铅蓄电池在放电过程中,负极质量增加,正极质量减少 |
| C、其他条件不变,向纯水中加入盐酸或氢氧化钠都能抑制水的电离,降低水的离子积 |
| D、常温下,向饱和碳酸钠溶液中加入过量碳酸钡粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则常温下Ksp(BaCO3)<Ksp(BaSO4) |
如图为A、B两种物质间的转化关系(其中C、D是反应物,部分产物已省略).以下判断不正确的是( )


| A、若A是AlCl3,则C既可以是强碱,也可以是弱碱 |
| B、若A是碱性气体,则A和C可能发生氧化还原反应,也可能发生非氧化还原反应 |
| C、上述变化过程中,A可以是酸、碱、盐,也可以是单质或氧化物 |
| D、若A→B是氧化还原反应,则C、D在上述转化过程中一定有一种为氧化剂,另一种为还原剂 |
下列关于浓硫酸的叙述不正确的是( )
| A、浓硫酸具有脱水性,因而能使蔗糖炭化 |
| B、浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
| C、浓硫酸是一种干燥剂,能够干燥二氧化硫、氢气等气体 |
| D、浓硫酸在常温下能够使铁、铝等金属钝化 |
如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )


| A、若A为醋酸,B为贝壳(粉状),D中盛C6H5ONa溶液,则D中溶液变浑浊 |
| B、若A为食盐水,B为电石,D中盛KMnO4酸性溶液,则D中溶液紫色褪去 |
| C、若A为浓氨水,B为生石灰,D中盛AgNO3溶液,则D中不会出现新的现象变化 |
| D、实验中仪器C可起到防止倒吸的作用 |
 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现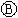 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述不正确的是( )
后,使c、d两点短路.下列叙述不正确的是( )| A、a为直流电源的正极 |
| B、c极发生的反应为2H++2e-=H2↑ |
| C、f电极为锌板 |
| D、e极发生氧化反应 |
下列叙述正确的是( )
①久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生
②若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
①久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生
②若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质.
| A、①⑥ | B、①④⑥ |
| C、②③④ | D、④⑤⑥ |
下列实验中,能够达到实验目的是( )
A、 实验室制取并收集氨气 |
B、 制取SO2并检验SO2的漂白性 |
C、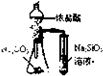 比较氯碳硅三种元素的非金属性强弱 |
D、 除去CO2中的HCl |