题目内容
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 物质 组别 | 甲 | 乙 | 丙 |
| A | FeCl2 | Cl2 | NaOH |
| B | SiO2 | NaOH | HF |
| C | AlCl3 | KOH | H2SO4 |
| D | SO2 | NaOH | NaHCO3 |
| A、A | B、B | C、C | D、D |
考点:二氧化硫的化学性质,氯气的化学性质,硅和二氧化硅
专题:氧族元素,碳族元素
分析:A.FeCl2具有还原性,可与Cl2发生氧化还原反应,可氢氧化钠反应生成氢氧化亚铁,Cl2与氢氧化钠反应可生成氯化钠、次氯酸钠;
B.二氧化硅可与NaOH、HF反应,NaOH、HF发生中和反应;
C.氯化铝与硫酸不反应;
D.二氧化硫可与NaOH、NaHCO3反应,NaOH、NaHCO3反应生成碳酸钠.
B.二氧化硅可与NaOH、HF反应,NaOH、HF发生中和反应;
C.氯化铝与硫酸不反应;
D.二氧化硫可与NaOH、NaHCO3反应,NaOH、NaHCO3反应生成碳酸钠.
解答:
解:A.FeCl2具有还原性,可与Cl2发生氧化还原反应生成氯化铁,可氢氧化钠反应生成氢氧化亚铁,Cl2与氢氧化钠反应可生成氯化钠、次氯酸钠,故A不选;
B.二氧化硅可与NaOH、HF反应,NaOH、HF发生中和反应,故B不选;
C.氯化铝与KOH反应生成氢氧化铝,但与硫酸不反应,故C选;
D.二氧化硫可与NaOH、NaHCO3反应,NaOH、NaHCO3反应生成碳酸钠,故D不选.
故选C.
B.二氧化硅可与NaOH、HF反应,NaOH、HF发生中和反应,故B不选;
C.氯化铝与KOH反应生成氢氧化铝,但与硫酸不反应,故C选;
D.二氧化硫可与NaOH、NaHCO3反应,NaOH、NaHCO3反应生成碳酸钠,故D不选.
故选C.
点评:本题综合考查元素化合物知识,为高考常见题型,把握常见物质的性质及发生的化学反应为解答的关键,注意某些反应与量有关,明确性质与反应的关系即可解答,题目难度不大.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
在恒温恒容的容器里进行下列反应:N2+3H2?2NH3,其他条件不变,向容器中充入氩气,则此反应速率会( )
| A、变大 | B、变小 |
| C、不变 | D、无法判断 |
有机物X、Y分子式不同,它们只含C、H、O元素中的两种或三种,若将X、Y不论何种比例混合,只要物质的量之和不变,完全燃烧时耗氧气量和生成的水的物质的量也不变.X、Y是( )
| A、C2H4、C2H6O |
| B、C2H2、C6H6 |
| C、CH2O、C3H6O |
| D、CH4、C2H4O2 |
 25°C时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25°C时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A、曲线I中滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、曲线I中滴加溶液到25 mL时:c(NH4+)>c(C1-)>c(H+)>c(OH-) |
| C、曲线II中滴加溶液在10 mL~25 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D、曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,某些反应与平衡常数数值如下:
2NO(g)?N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是( )
2NO(g)?N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
下列说法中正确的是( )
| A、常温下,水分解产生O2,此时平衡常数的值约为5×10-80 | ||
| B、常温下,最易分解放出O2的是水 | ||
C、K3=
| ||
| D、以上都不正确 |
下列叙述不正确的是( )
| A、稀HNO3和金属反应时主要得到氢气 |
| B、NH3易液化,液氨常用作制冷剂 |
| C、利用氨气极易溶于水,氨气可以做喷泉实验 |
| D、铵盐受热易分解,贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
 系统命名为
系统命名为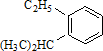 的炔烃的结构简式
的炔烃的结构简式