题目内容
 为了制得较纯净的Fe(OH)2,甲乙两同学分别用下面两种方法制得白色的Fe(OH)2沉淀.
为了制得较纯净的Fe(OH)2,甲乙两同学分别用下面两种方法制得白色的Fe(OH)2沉淀.同学甲:用新制的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
②除去蒸馏水中溶解的O2常采用
③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.
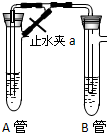
同学乙:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.A管中是Fe和H2SO4,B管中是NaOH溶液.
①先打开a,使A管中反应一段时间后再夹紧止水夹a,这样做的目的是
②操作①后B管中发生反应的离子方程式为
分析:甲同学:硫酸亚铁易被氧化而变质,应排除溶液中的氧气;可用加热溶液的方法除去溶解氧,防止亚铁离子被氧化,须加入铁粉;
乙同学:A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气,可排除试管中的氧气,可防止生成的Fe (OH)2被氧化,操作①后B管中亚铁离子和碱反应生成氢氧化亚铁,制得白色的Fe(OH)2沉淀.
乙同学:A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气,可排除试管中的氧气,可防止生成的Fe (OH)2被氧化,操作①后B管中亚铁离子和碱反应生成氢氧化亚铁,制得白色的Fe(OH)2沉淀.
解答:解:同学甲:①硫酸亚铁易被氧化而变质生成硫酸铁,因FeSO4溶液与铁反应为:Fe+Fe2(SO4)3═3FeSO4,所以用硫酸亚铁晶体配制上述FeSO4溶液时还需加入铁粉,
故答案为:Fe粉;
②气体的溶解度随着温度的升高而降低,除去蒸馏水中溶解的O2常采用加热煮沸的方法,
故答案为:加热煮沸;
同学乙:①Fe(OH)2易被氧化而变质,先打开a,A管中发生反应Fe+2H+=Fe2++H2↑,生成氢气,再夹紧止水夹a,A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气,可排除试管中的氧气,可防止生成的Fe (OH)2被氧化,
故答案为:A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气;
②操作①后B管中B管中Fe2++2OH-=Fe(OH)2↓,生成沉淀为Fe(OH)2,
故答案为:Fe2++2OH-=Fe(OH)2↓.
故答案为:Fe粉;
②气体的溶解度随着温度的升高而降低,除去蒸馏水中溶解的O2常采用加热煮沸的方法,
故答案为:加热煮沸;
同学乙:①Fe(OH)2易被氧化而变质,先打开a,A管中发生反应Fe+2H+=Fe2++H2↑,生成氢气,再夹紧止水夹a,A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气,可排除试管中的氧气,可防止生成的Fe (OH)2被氧化,
故答案为:A管中产生的气体通入B管中排尽B管中的空气,使B充满还原性气体氢气;
②操作①后B管中B管中Fe2++2OH-=Fe(OH)2↓,生成沉淀为Fe(OH)2,
故答案为:Fe2++2OH-=Fe(OH)2↓.
点评:本题考查制备实验的设计,题目难度不大,本题注意根据硫酸亚铁和氢氧化亚铁的性质进行判断,注意把握实验的操作原理.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
 为了制得较纯净的Fe(OH)2,甲乙两同学分别用下面两种方法制得白色的Fe(OH)2沉淀.
为了制得较纯净的Fe(OH)2,甲乙两同学分别用下面两种方法制得白色的Fe(OH)2沉淀.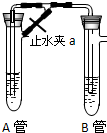 为了制得较纯净的Fe(OH)2,甲乙两同学分别用下面两种方法制得白色的Fe(OH)2沉淀.
为了制得较纯净的Fe(OH)2,甲乙两同学分别用下面两种方法制得白色的Fe(OH)2沉淀.