题目内容
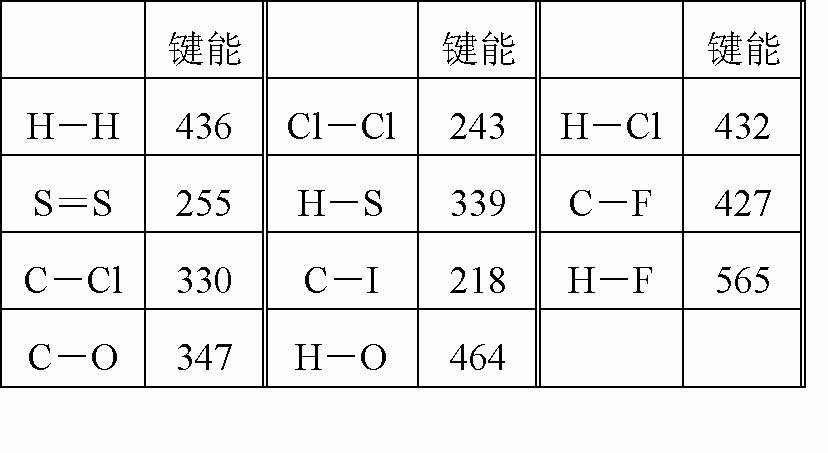
根据下表的键能的数据,可计算出甲烷的燃烧热△H是( )
|
分析:根据化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差来判断.
解答:解:因化学反应所吸收或放出的能量即为反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差,
甲烷燃烧的化学反应:CH4+2O2═CO2+2H2O,
旧化学键断裂吸收的能量为:414×4+497×2=2650(kJ),
新键生成释放的能量为:803×2+463×4=3458(kJ),
所以化学反应是放热反应,放出的热量为:3458kJ-2650kJ=808kJ,即△H=-808kJ/mol,
故选:B.
甲烷燃烧的化学反应:CH4+2O2═CO2+2H2O,
旧化学键断裂吸收的能量为:414×4+497×2=2650(kJ),
新键生成释放的能量为:803×2+463×4=3458(kJ),
所以化学反应是放热反应,放出的热量为:3458kJ-2650kJ=808kJ,即△H=-808kJ/mol,
故选:B.
点评:本题考查学生化学反应的能量变化和化学键键能之间的关系,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成新化学键放出的能量之和的差.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
| |||||||||||||||||||