题目内容
7.NA表示阿伏加德罗常数的值.下列关于某些化学过程的描述中:①1mol N2中含有的共价键数为2NA;
②在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA;
③密闭容器中2mol NO与1molO2完全反应,最终产物的分子数为2NA;
④将0.1mol CO2通入足量NaOH溶液中,则反应后溶液中阴离子数目为0.1NA;
⑤含NA个Na+的Na2O2溶于1L水中,Na+物质的量浓度为1mol•L-1
错误的是( )
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | 全部 |
分析 ①氮气中含有氮氮三键;
②过氧化钠与水的反应中,当生成1mol氧气时转移2mol电子;
③NO2和N2O4之间存在转化,方程式2NO2?N2O4;
④CO2通入足量NaOH溶液中,生成Na2CO3;
⑤含NA个Na+的Na2O2钠离子物质的量为1mol,浓度c=$\frac{n}{V}$,溶于1L水中过氧化钠和水反应,溶液体积不是1L.
解答 解:①氮气中含有氮氮三键,1mol N2中含有的共价键数为3NA,故①错误;
②过氧化钠与水的反应中,当生成1mol氧气时转移2mol电子,则当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故②错误;
③NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于2NA,故③错误;
④CO2通入足量NaOH溶液中,生成Na2CO3,故溶液中的阴离子有碳酸根和氢氧根,而由于氢氧化钠的物质的量不明确,故溶液中的阴离子的物质的量和个数无法计算,故④错误;
⑤含NA个Na+的Na2O2钠离子物质的量为1mol,浓度c=$\frac{n}{V}$,溶于1L水中过氧化钠和水反应,溶液体积不是1L,Na+物质的量浓度不是1mol•L-1 ,故⑤错误;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用、物质的结构、化学反应本质是解题关键,题目难度中等.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 金属单质只有还原性 | |
| C. | 得电子越多的氧化剂,其氧化性就越强 | |
| D. | 元素的单质只能由氧化含该元素的化合物来制取 |
15.嫦娥二号卫星采用“长三丙火箭”进行发射,其第三级推进器使用的燃料是液态氢.已知在25℃时,2g H2(g)与O2(g)完全反应生成H2O(g)时放热241.8kJ.则下列有关判断正确的是( )
| A. | H2 (g)的燃烧热是-241.8 kJ/mol | |
| B. | 25℃时,H2(g)+$\frac{1}{2}$O2═H2O(1)△H>-241.8 kJ/mol | |
| C. | 25℃时,22.4 L H2完全燃烧生成H2O(g)放出的热量为241.8 kJ | |
| D. | 已知H2O(g)═H2O(1)△H=-44 kJ/mol.则H2O (1)═H2(g)+$\frac{1}{2}$O2(g)△H=+285.8 kJ/mol |
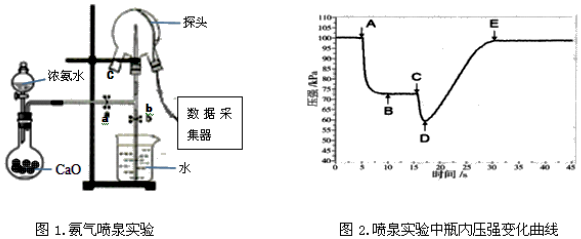
2.依据如图判断,下列说法正确的是( )

| A. | 氢气的燃烧热△H=-241.8 kJ•mol-1 | |
| B. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
12.在某溶液M中加入物质X,物理量y与物质X体积的关系如图所示,下列有关溶液M、物质X和物理量y的推断合理的是( )


| 选项 | 溶液M | 物质X | 物理量y |
| A | 含Mg2+、Al3+、NH4+的溶液 | KOH溶液 | 沉淀的物质的量 |
| B | 含CO32-、HCO3-的溶液 | 盐酸 | 二氧化碳的体积 |
| C | 含OH-、AlO2-、SiO3 2-、CO32-的溶液 | NaHSO4溶液 | 沉淀的质量 |
| D | 含Ba(OH)2、NaOH、NaAlO2的溶液 | CO2 | 沉淀的物质的量 |
| A. | A | B. | B | C. | C | D. | D |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol丙烯酸中含有的双键数目为0.1 NA | |
| B. | 常温常压下,4.6 g NO2和N2O4的混合气体中分子总数为0.3 NA | |
| C. | 标准状况下,2.24 L Cl2与足量水反应转移的电子数目为0.1 NA | |
| D. | 7.8 g Na2O2固体中含有的离子总数为0.3 NA |
16.NA表示阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 标准状况下22.4L水含有的分子数为NA | |
| B. | 0.5mol氢气中氢原子数为6NA | |
| C. | 常温下5.6g铁与足量盐酸反应失去的电子数为0.2NA | |
| D. | 标准状况下22.4LCO2与CO的混合气体含分子数为NA |
17.已知:将a mol Cl2通入含b mol NaOH的溶液中两者恰好完全反应,产物中可能有NaCl、NaClO、NaClO3.温度不同,三者的量也不同.下列说法不正确的是( )
| A. | 改变温度,当产物中NaClO3的物质的量最大时,发生的离子反应为:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O | |
| B. | 某温度下,反应后若溶液中c(ClO-):c(ClO3-)=1:2,发生的离子反应为:7Cl2+14OH-$\frac{\underline{\;\;△\;\;}}{\;}$11Cl-+ClO-+2ClO3-+7H2O | |
| C. | 参加反应的Cl2与NaOH的物质的量的关系一定是a=0.5b | |
| D. | 改变温度,反应中转移电子的物质的量可能为b mol |