题目内容
19.在标准状况下,将一个充满HC1气体和氧气的集气瓶倒放在盛水的水槽中,水面上升到集气瓶容积的$\frac{2}{3}$.把集气瓶从水中取出(假设HC1全部留在集气瓶中).则集气瓶中溶液的溶质的质量分数为0.163%:若溶液密度的变化忽略不计.则HC1的物质的量浓度为0.045mol/L.分析 HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的$\frac{2}{3}$就停止了,则氯化氢体积$\frac{2}{3}$VL,溶液体积为$\frac{2}{3}$VL,n(HCl)=$\frac{\frac{2}{3}VL}{22.4L/mol}$=$\frac{2}{3×22.4}$mol,根据溶液的溶质的质量分数=$\frac{m(溶质)}{m(溶液)}$×100%计算集气瓶中溶液的溶质的质量分数,根据c=$\frac{n}{V}$计算盐酸浓度.
解答 解:HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的$\frac{2}{3}$就停止了,则氯化氢体积$\frac{2}{3}$VL,溶液体积为$\frac{2}{3}$VL,n(HCl)=$\frac{\frac{2}{3}VL}{22.4L/mol}$=$\frac{2}{3×22.4}$Vmol,m(HCl)=$\frac{2}{3×22.4}$Vmol×36.5g/mol,水的质量为:$\frac{2}{3}$V×1000×1g/mL,则集气瓶中溶液的溶质的质量分数为$\frac{\frac{2}{3×22.4}V×36.5}{\frac{2×V×36.5}{3×22.4}+\frac{2}{3}V×1000}$≈0.163%,
盐酸浓度c=$\frac{n}{V}$=$\frac{\frac{2}{3×22.4}mol}{\frac{2}{3}L}$=$\frac{1}{22.4}$mol/L≈0.045mol/L,
故答案为:0.163%;0.045mol/L.
点评 本题考查物质的量的有关计算,侧重考查学生分析判断及计算能力,明确水上升体积与HCl气体体积关系是解本题关键,熟悉物质的量公式中各个物理量的关系,题目难度不大.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | 金属原子失去电子而被氧化的过程,即金属原子转化为阳离子的过程 | |
| B. | 金属与氧化剂直接反应 | |
| C. | 无电流 | |
| D. | 有电流 |
| A. | 原子半径:b>c>d | |
| B. | 气态氢化物稳定性:a>c | |
| C. | 简单阴离子还原性:d>c | |
| D. | ab可形成既含离子键又含共价键的离子化合物 |
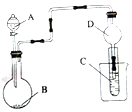
| A. | 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中产生白色沉淀,白色沉淀不会消失 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 若A为浓盐酸,B为贝壳,C中盛有硅酸钠溶液,则C中出现白色沉淀可证明酸性的强弱为:碳酸>硅酸 |
| A. | 物质的量浓度相等的盐酸和氨水等体积混合,所得溶液的pH<7 | |
| B. | 物质的量浓度相等的硫酸和氨水等体积混合,所得溶液的pH<7 | |
| C. | pH=3的盐酸和pH=11的氨水等体积混合,所得溶液的pH>7 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合,所得溶液的pH<7 |
| A. | C8H10中只有3种属于芳香烃的同分异构体 | |
| B. | 苯与溴水混合振荡,水层颜色变浅 | |
| C. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| D. | 油脂、蛋白质、纤维素均属于高分子化合物,可以发生水解 |
