题目内容
3.下列说法正确的是( )| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的气体不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同 | |
| D. | 将SO2与Cl2混合后通入品红溶液中漂白效果更好 |
分析 A.二氧化硫不能使酸碱指示剂褪色;
B.二氧化硫、次氯酸等物质都能使品红溶液褪色;
C.漂白粉和过氧化钠的漂白性是利用其氧化性,活性炭的漂白性是利用其吸附性,二氧化硫的漂白性是因为和有色物质反应生成无色物质;
D.二者恰好反应生成盐酸和硫酸,盐酸和硫酸没有漂白性.
解答 解:A.二氧化硫的漂白性是因为和有色物质反应生成无色物质而漂白品红溶液,二氧化硫被溴、酸性高锰酸钾氧化而使这两种物质褪色,二氧化硫不能使酸碱指示剂褪色,故A错误;
B.二氧化硫、次氯酸等物质都能使品红溶液褪色,所以能使品红溶液褪色的物质不一定是SO2,故B正确;
C.漂白粉和过氧化钠的漂白性是利用其氧化性,活性炭的漂白性是利用其吸附性,二氧化硫的漂白性是因为和有色物质反应生成无色物质,所以其漂白原理不一定相同,故C错误;
D.二者恰好反应生成盐酸和硫酸,反应方程式为Cl2+SO2+2H2O=H2SO4+2HCl,盐酸和硫酸没有漂白性,所以等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中不能使有色布条褪色,故D错误;
故选B.
点评 本题考查了漂白原理,知道活性炭、漂白粉和过氧化钠及臭氧、二氧化硫漂白原理分别是什么,注意:二氧化硫能使品红溶液褪色但不能使酸碱指示剂褪色,为易错点,题目难度中等.

练习册系列答案
相关题目
11.CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应说法正确的是( )


| A. | 该反应为吸热反应 | |
| B. | 1molCO(g)和1mol H2O(g)所具有的总能量大于1molCO2(g)和1molH2(g)具有的总能量 | |
| C. | 反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g);△H=+41kJ•mol-1 | |
| D. | 1molCO2(g)和1molH2(g)反应生成1molCO(g)和H2O(g)要放出41kJ的热量 |
18.有关如图所示化合物的说法不正确的是( )
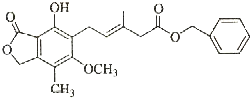

| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以催化加氢,1mol该物质最多可与7mol H2反应 | |
| D. | 该化合物有4种官能团,可以使酸性KMnO4溶液褪色 |
15.下列说法正确的是( )
| A. | 在25℃、1.01×105Pa的条件下,22.4L H2中含有的分子数为0.1NA | |
| B. | 1L 1mol•L-1的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 40g NaOH溶解在1L水中,所制得的100mL溶液中含Na+数为0.1NA | |
| D. | 22g CO2与标准状况下11.2L H2O含有相同分子数 |
13. 反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.
反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.
 反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.
反应:aA(g)+bB(g)cC(g)+dD(g)中A的转化率和含量符合如图所示变化关系,下列叙述中,正确的是.| A. | 压强P1比P2大 | B. | (a+b)比(c+d)大 | ||
| C. | 温度t1℃比t2℃低 | D. | 正反应为吸热反应. |
 NH3•H2O
NH3•H2O NH4++OH-.
NH4++OH-.