题目内容
 Al-H202电池功率大,可作为许多机械的动力电池,其结构如图所示.下列说法不正确的是( )
Al-H202电池功率大,可作为许多机械的动力电池,其结构如图所示.下列说法不正确的是( )| A、铝作负极,电池工作时将不断溶解 |
| B、该电池不是二次电池,不可充电 |
| C、碳纤维电极的电极反应是H202+2e-+2H+=2H2O |
| D、电池工作时OH-从碳纤维电极透过离子交换膜移向Al电极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、原电池原理分析,铝做负极;
B、是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池;
C、碳纤维电极为原电池正极,过氧化氢得到电子被还原生成水,据此书写电极反应;
D、原电池中阴离子移向负极;
B、是指在电池放电后可通过充电的方式使活性物质激活而继续使用的电池;
C、碳纤维电极为原电池正极,过氧化氢得到电子被还原生成水,据此书写电极反应;
D、原电池中阴离子移向负极;
解答:
解:A、依据原电池原理分析可知,铝作负极,电池工作时将不断溶解,Al-3e-+4OH-=2H2O+AlO2-,故A正确;
B、依据反应原理和反应过程分析,该电池不是二次电池,不可充电,属于一次性电池,故B正确;
C、碳纤维电极为原电池正极,碱性电解质溶液中,碳纤维电极的电极反应是H202+2e-=2OH-,故C错误;
D、原电池中阴离子移向负极,所以电池工作时OH-从碳纤维电极透过离子交换膜移向Al电极,故D正确;
故选C.
B、依据反应原理和反应过程分析,该电池不是二次电池,不可充电,属于一次性电池,故B正确;
C、碳纤维电极为原电池正极,碱性电解质溶液中,碳纤维电极的电极反应是H202+2e-=2OH-,故C错误;
D、原电池中阴离子移向负极,所以电池工作时OH-从碳纤维电极透过离子交换膜移向Al电极,故D正确;
故选C.
点评:本题考查了原电池原理的分析应用,电极反应书写,掌握原理是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
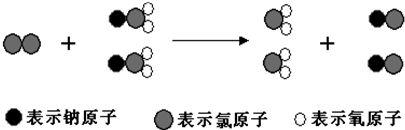
下列有关叙述中正确的是( )

下列有关叙述中正确的是( )
| A、该反应是复分解反应 |
| B、ClO2 的消毒效率(等质量时得到电子的多少)是Cl2 的2.63倍 |
| C、反应中Cl2既是氧化剂,又是还原剂 |
| D、生成2mol ClO2时转移的电子数为6mol |
将含有KCl,CuBr2,Na2SO4 三种物质的水溶液(分别为1mol/L)用铂电极进行电解至足够长时间.有以下结论:①溶液中几乎没有Br-;②电解液变为无色;③最终溶液呈碱性;④K+,Na+和SO42-的浓度几乎没有变化.正确的是( )
| A、①②③ | B、仅③ |
| C、①④ | D、均正确 |
“复盐”是指含多种简单阳离子和一种酸根离子组成的盐,如KAl(SO4)2.而一种金属离子与多种酸根离子构成的盐则称为“混盐”,如氯化硝酸钙[Ca(NO3)2Cl].下列化合物属于混盐的是( )
| A、Ca2O2Cl4 |
| B、KCl?MgCl2?6H2O |
| C、KMnO4 |
| D、Cu2(OH)2CO3 |
二氟甲烷(CH2F2)是性能优异的环保产品,试判断二氟甲烷的结构( )
| A、有4种 | B、有3种 |
| C、有2种 | D、有1种 |
电化学降解法可用于治理水中硝酸盐的污染.降解NO3-的原理如图所示.下列说法不正确的是( )

| A、直流电源A为正极、B为负极 |
| B、当电解过程中质子从Pt电极向Ag-Pt电极移动 |
| C、在阳极发生的电极反应:2H2O-4e-=O2+4H+ |
| D、当电解过程转移2mol电子时,阴极室质量减少5.6g |
下列各组物质属于同分异构体的是( )
| A、金刚石和富勒烯(C60) |
B、CH3CH2CH2CH3和 |
| C、12CO和14CO |
| D、CH3CH3 和CH3CH2CH3 |