题目内容
工业上生产硫酸时,利用催化氢化反应将SO2转化为SO3是一个关键步骤.
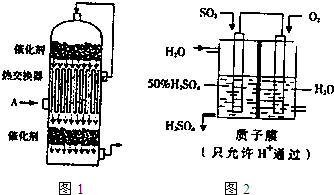
(1)SO2转化为SO3是在接触室(如图1)里进行的,中部是一个热交换器,它是由导热性能良好的管状材料(如铜管)制成.温度低的气体A从管外流过,上层催化剂反应后的热气体从管内流过,通过导热材料进行气体与气体的热交换.实验室里有很多实验也需要进行热交换(除直接加热外),如在进行气体和气体热交换时,通常使用玻璃导管,气体和液体热交换时,通常使用 (填仪器名称),请你举一例有液体与流体热交换的化学实验 (填实验名称).
(2)某温度下,2SO2(g)+O2(g)?2SO3(g)△H=-196kJ?mol-1.开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为 ,该温度下平衡常数K= ;
(3)一定温度下,向体积为1L的密闭容器中充入2molSO3(g)和1molO2(g),发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO2的体积分数为a.若保持温度不变,以下列量作为起始量发生反应,达到平衡后SO2体积分数仍为a的是 (填字母).
A.向体积为1L的容器中充入2molSO3
B.向体积为1L的容器中充入4molSO2和2molO2
C.向体积为1L的容器中充入1.8molSO2、0.9molO2、0.2molSO3
D.向体积为0.5L的容器中充入1molSO2和0.5molO2
E.向体积为0.5L的容器中充入2molSO2和1molO2
(4)某学生庙想以如图2所示装置的电化学原理生产硫酸,写出通入O2一极的电极反应式 .
(5)若通入SO2的速率为2.24L?min-1(标准状况),为稳定持续生产,硫酸溶液的质量分数应维持50%,则左侧水的流入速率应为 mL?min-1.

(1)SO2转化为SO3是在接触室(如图1)里进行的,中部是一个热交换器,它是由导热性能良好的管状材料(如铜管)制成.温度低的气体A从管外流过,上层催化剂反应后的热气体从管内流过,通过导热材料进行气体与气体的热交换.实验室里有很多实验也需要进行热交换(除直接加热外),如在进行气体和气体热交换时,通常使用玻璃导管,气体和液体热交换时,通常使用
(2)某温度下,2SO2(g)+O2(g)?2SO3(g)△H=-196kJ?mol-1.开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为
(3)一定温度下,向体积为1L的密闭容器中充入2molSO3(g)和1molO2(g),发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO2的体积分数为a.若保持温度不变,以下列量作为起始量发生反应,达到平衡后SO2体积分数仍为a的是
A.向体积为1L的容器中充入2molSO3
B.向体积为1L的容器中充入4molSO2和2molO2
C.向体积为1L的容器中充入1.8molSO2、0.9molO2、0.2molSO3
D.向体积为0.5L的容器中充入1molSO2和0.5molO2
E.向体积为0.5L的容器中充入2molSO2和1molO2
(4)某学生庙想以如图2所示装置的电化学原理生产硫酸,写出通入O2一极的电极反应式
(5)若通入SO2的速率为2.24L?min-1(标准状况),为稳定持续生产,硫酸溶液的质量分数应维持50%,则左侧水的流入速率应为
考点:化学平衡的计算,常见化学电源的种类及其工作原理,化学平衡常数的含义,等效平衡
专题:化学平衡专题,电化学专题
分析:(1)冷凝管可把蒸气和冷却水进行能量交换,水浴加热是液体和液体进行能量交换;
(2)依据化学平衡三段式列式计算得到,据转化率公式求出SO2的转化率,根据平衡浓度计算平衡常数;
(3)根据平衡的特征和原平衡等效判断;
(4)原电池正极发生还原反应,氧气被还原生成水;
(5)电池的总反应式为:2SO2+2H2O+O2=2H2SO4,根据方程式计算,注意硫酸的浓度不变.
(2)依据化学平衡三段式列式计算得到,据转化率公式求出SO2的转化率,根据平衡浓度计算平衡常数;
(3)根据平衡的特征和原平衡等效判断;
(4)原电池正极发生还原反应,氧气被还原生成水;
(5)电池的总反应式为:2SO2+2H2O+O2=2H2SO4,根据方程式计算,注意硫酸的浓度不变.
解答:
解:(1)冷凝管可把蒸气和冷却水进行能量交换,水浴加热是液体和液体进行能量交换,故答案为:冷凝管;实验室制硝基苯或银镜反应;
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ,根据热化学方程式可知,参加反应的二氧化硫为2mol;
2SO2(g)+O2(g)?2SO3(g)
开始量(mol) 4 10 0
变化量(mol) 2 1 2
平衡量(mol) 2 9 2
所以SO2的转化率α=
×100%=50%,
该温度下平衡常数K=
=
=
=11.1,
故答案为:50%;11.1;
(3)A.向体积为1L的容器中充入2molSO3,平衡向逆反应分析移动,达平衡后和原平衡等效,故A正确;
B.向体积为1L的容器中充入4molSO2和2molO2,相当于加压,平衡正向移动,二氧化硫含量较少,故B错误;
C.向体积为1L的容器中充入1.8molSO2、0.9molO2、0.2molSO3,采用极值转化法可知和原平衡等效,故C正确;
D.向体积为0.5L的容器中充入1molSO2和0.5molO2,和原平衡等效,故D正确;
E.向体积为0.5L的容器中充入2molSO2和1molO2,相当于加压,平衡正向移动,二氧化硫含量减少,故E错误;
故答案为:ACD;
(4)依据图装置分析,二氧化硫失电子发生氧化反应,氧气得电子发生还原反应,电极反应为:O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
(5)电池的总反应式为:2SO2+2H2O+O2=2H2SO4,1min内n(SO2)=
=0.1mol,消耗水0.1mol,生成硫酸的质量为:0.1mol×98g/mol=9.8g,消耗水的质量为:0.1mol×18g/mol=1.8g,
设1min内通入xmLH2O,
则有:
=0.5
x=11.6mL/min,
故答案为:11.6.
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ,根据热化学方程式可知,参加反应的二氧化硫为2mol;
2SO2(g)+O2(g)?2SO3(g)
开始量(mol) 4 10 0
变化量(mol) 2 1 2
平衡量(mol) 2 9 2
所以SO2的转化率α=
| 2mol |
| 4mol |
该温度下平衡常数K=
| c2(SO3) |
| c2(SO2)?c(O2) |
(
| ||||
(
|
| 100 |
| 9 |
故答案为:50%;11.1;
(3)A.向体积为1L的容器中充入2molSO3,平衡向逆反应分析移动,达平衡后和原平衡等效,故A正确;
B.向体积为1L的容器中充入4molSO2和2molO2,相当于加压,平衡正向移动,二氧化硫含量较少,故B错误;
C.向体积为1L的容器中充入1.8molSO2、0.9molO2、0.2molSO3,采用极值转化法可知和原平衡等效,故C正确;
D.向体积为0.5L的容器中充入1molSO2和0.5molO2,和原平衡等效,故D正确;
E.向体积为0.5L的容器中充入2molSO2和1molO2,相当于加压,平衡正向移动,二氧化硫含量减少,故E错误;
故答案为:ACD;
(4)依据图装置分析,二氧化硫失电子发生氧化反应,氧气得电子发生还原反应,电极反应为:O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
(5)电池的总反应式为:2SO2+2H2O+O2=2H2SO4,1min内n(SO2)=
| 2.24L |
| 22.4L/mol |
设1min内通入xmLH2O,
则有:
| 9.8g |
| 9.8g+x×1g/mL-1.8g |
x=11.6mL/min,
故答案为:11.6.
点评:本题考查较为综合,涉及化学平衡和电化学知识,题目难度中等,本题易错点为(5),注意根据浓度不变结合反应的化学方程式计算.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、分子、原子、离子都是构成物的粒子 |
| B、由同种元素组成的物质不一定是纯净物 |
| C、含有氧元素的化合物称为氧化物 |
| D、含有羟基的有机物不一定属于醇 |
下列物质中所含分子的物质的量最多的是( )
| A、标准状况下11.2LHCl |
| B、6.02×1023个CO2 |
| C、36gH2O(H2O的摩尔质量为18g?mol-1) |
| D、1.5molN2 |

 化合物A的分子式为C3H6O2,B能发生银镜反应,有图示的转化关系,
化合物A的分子式为C3H6O2,B能发生银镜反应,有图示的转化关系, ),有一定的致癌作用.对苯二胺属于
),有一定的致癌作用.对苯二胺属于