��Ŀ����
9����������FePO4•2H2O��������ˮ���װ�ɫ���壩����������ҩ�ʳƷ���Ӽ�������ӵ�ص��������ϣ�ʵ���ҿ�ͨ������ʵ���Ʊ�����������1����ȡһ�����ѳ�ȥ���۵ķ���м�������Թ�����ϡ���ᣬ���ȡ����裬��Ӧһ��ʱ�����ˣ���Ӧ���ȵ�Ŀ���Ǽӿ�Fe��ϡ����ķ�Ӧ���ʣ�
��2������Һ�м���һ����H2O2����Fe2+��Ϊȷ������H2O2������������KMnO4����Һ�ζ���Һ�е�Fe2+��
��д��H2O2����Fe2+�����ӷ���ʽ��H2O2+2Fe2++2H+=2H2O+2Fe3+
��������ʽ������ʽ���ʽ���ζ���ע��KMnO4����Һǰ���ζ�����Ҫ��©��ˮϴ����ϴ��
�����ζ�v mL��Һ�е�Fe2+������a mol•L-1 KMnO4����Һb mL��
����Һ��c��Fe2+��=$\frac{5ab}{V}$ mol•L-1
��Ϊʹ��Һ�е�Fe2+��ȫ��H2O2����������ʵ������������ȷ����AB������ţ���
A�������ʵ�������H2O2��Һ
B�������μ�H2O2��Һ������
C�����ȣ�ʹ��Ӧ�ڽϸ��¶��½���
D���ð�ˮ����pH=7��
���� ��1���¶�Խ�ߣ���Ӧ����Խ�죻
��2����������Һ��H2O2����Fe2+��Ӧ���������ӣ���ϵ���غ��ԭ���غ���ƽ��д�õ����ӷ���ʽ��
�ڸ��������Һ����ǿ�����ԣ�Ӧװ����ʽ�ζ����У�
�۸���Fe2+��KMnO4֮��Ĺ�ϵʽ���������������ʵ���������õ�Ũ�ȣ�
��Ϊʹ��Һ�е�Fe2+��ȫ��H2O2�����������������Ҫ��������ʹ��Ӧ���ַ�Ӧ��
��� �⣺��1���¶�Խ�ߣ���Ӧ����Խ�죬���Է�Ӧ���ȵ�Ŀ���Ǽӿ�����ϡ���ᷴӦ���ʣ��ʴ�Ϊ���ӿ�Fe��ϡ����ķ�Ӧ���ʣ�
��2����������Һ��H2O2����Fe2+��Ӧ���������ӣ���Ӧ�����ӷ���ʽΪ��H2O2+2Fe2++2H+=2H2O+2Fe3+��
�ʴ�Ϊ��H2O2+2Fe2++2H+=2H2O+2Fe3+��
��KMnO4����Һ����ǿ�����ԣ��������ܣ���Ҫʢ������ʽ�ζ����У�
�ʴ�Ϊ����ʽ��
�����ζ�v mL��Һ�е�Fe2+������a mol•L-1 KMnO4����Һb mL��MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O��
����Fe2+��KMnO4֮��Ĺ�ϵʽ��c��Fe2+��=$\frac{amol/L��b��1{0}^{-3}L��5}{v��1{0}^{-3}L}$=$\frac{5ab}{V}$mol/L��
�ʴ�Ϊ��$\frac{5ab}{V}$��
��A�������ʵ�������H2O2��Һ����������������ȫ��Ӧ����A��ȷ��
B�������μ�H2O2��Һ�����裬��Ӧ��Ӵ����������ʹ��������ȫ��Ӧ����B��ȷ��
C�����ȣ�ʹ��Ӧ�ڽϸ��¶��½��У���Ȼ��Ӧ���ʼӿ죬���ܴٽ���������ˮ����������ʣ���C����
D���ð�ˮ������ҺpH=7���������Ӻ����������ӷ�Ӧ�����������������ʣ��ʴ���
��ѡAB��
���� �����������仯����Ϊ���忼�������ʵ��Ʊ����漰������ԭ��Ӧ��ʵ���������Ӧ���ʵ�Ӱ�����ص�֪ʶ�㣬��������֮��Ĺ�ϵʽ��ʵ������Ĺ淶�ԡ�Ӱ�췴Ӧ���ʵ����ص�֪ʶ�������������Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ��״���£�18g H20���Ϊ22.4L | |
| B�� | 2L 0.5mol/L CH3COOH��Һ�к��е�H+����ĿΪNA | |
| C�� | 0.1molп������ϡ���ᷴӦ��ת�Ƶĵ�����Ϊ0.1NA | |
| D�� | ���³�ѹ��4.6g NO2��N2O4�Ļ�����壬ԭ����Ϊ0.3NA |
| HA | H2B | H2C | H3D |
| 1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=9.1��10-8 K2=1.1��10-12 | K1=7.5��10-3 K2=6.2��10-8 K3=2.2��10-13 |
��2��HA��H2B��H2C��H3D��������������ǿ����H3D����������H2C��
��3����10mL 0.01mol/L Na2B��Һ����μ���10mL 0.01mol/L HA��Һ������ֽ��裬��Ӧ�����ӷ���ʽ��B2-+HA=HB-+A-��
��4���������ʵ�����HA��H2B��H2C��NaH2D����ˮ��ɻ����Һ������μ����ռ���Һ���������������������ռӦ�����ӷ���ʽ��H3D+OH-=H2O+H2D-���������������ռ���Һ�������OH-��Ӧ��������HD2-+OH-=H2O+D3-��
CH2OH��CHOH��4CHO+Br2+H2O��C6H12O7���������ᣩ+2HBr
2C6H12O7���������ᣩ+CaCO3��Ca��C6H11O7��2����������ƣ�+H2O+CO2��
������ʵ��ܽ��Լ��±���
| �������� | ��������� | �������� | �廯�� | �Ȼ��� |
| ˮ�е��ܽ��� | ��������ˮ��������ˮ | ���� | ���� | ���� |
| �Ҵ��е��ܽ��� | �� | �� | ���� | ���� |
��������Һ�μ�3%��ˮ/55�棺�ٹ���CaCO3/70��ڳ��ȹ��� ���Ҵ� ������Һ
���ˢ�ϴ�Ӣ����Ca��C6H11O7��2
��������Һ$��_{��}^{�μ�3%��ˮ/55��}$ $\underset{\stackrel{����CaC{O}_{3}/70��}{��}}{��}$ $��_{��}^{���ȹ���}$ $��_{��}^{�Ҵ�}$ ����Һ$��_{��}^{����}$ $��_{��}^{ϴ��}$$��_{��}^{����}$Ca��C6H11O7��2
��ش��������⣺
��1���� �ٲ�����ˮ����������ʱ������װ������ʵ���B������ţ���
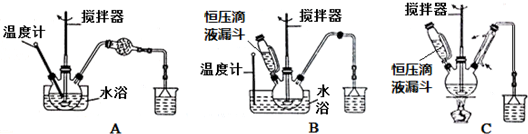
��2���� �ڲ���ַ�Ӧ��CaCO3��������ʣ�࣬��Ŀ����������������ת���ʣ��ҹ�����̼����׳�ȥ��
��3����ʵ���в�����CaCl2���CaCO3���������Ȼ�����������������ֱ�ӷ�Ӧ�Ƶ���������ƣ�
��4���� �۲�����ȹ��ˣ���ԭ���������������ȴ���ᾧ�������粻���ȹ��˻���ʧ��Ʒ��
��5����������Һ������Cu��OH��2����Һ��Ӧ�Ļ�ѧ����ʽΪCH2OH��CHOH��4CHO+2Cu��OH��2+NaOH$\stackrel{��}{��}$CH2OH��CHOH��4COONa+Cu2O��+3H2O��
| A�� | ��ǿ | B�� | ���� | C�� | ���� | D�� | ���ж� |

 ��
�� ����ʡ��2013��12��1����ʱ�𣬳�����������Ϊ�������������Զ���������ŷ����˴��ĸ��ƣ���֪SO2������Fe�� NO3��3��Һ���գ�0.1mol/L��Fe��NO3��3��Һ��pH=2ijѧϰС��ݴ�չ���������̽����
����ʡ��2013��12��1����ʱ�𣬳�����������Ϊ�������������Զ���������ŷ����˴��ĸ��ƣ���֪SO2������Fe�� NO3��3��Һ���գ�0.1mol/L��Fe��NO3��3��Һ��pH=2ijѧϰС��ݴ�չ���������̽����

 $\stackrel{��������}{��}$
$\stackrel{��������}{��}$ ��R��R�����������
��R��R����������� ��
�� ��
��