题目内容
12.(含NaCl杂质)中碳酸钠质量分数的实验方案.请回答下列某研究性学习小组设计了测定纯碱样品问题:(1)碳酸根离子沉淀法.实验步骤:
①用托盘天平称取样品放入烧杯中加水溶解;
②加入足量BaCl2溶液充分反应.证明反应后BaCl2剩余的方法是静置,取少量上层清液滴加碳酸钠溶液,有白色沉淀生成,证明氯化钡剩余;
③过滤、洗涤、干燥、称量沉淀的质量为mg;
④样品中碳酸钠的质量分数为$\frac{106m}{197w}$×100%.
(2)气体法.学习小组利用如图装置测定样品中碳酸钠的质量分数.

①实验装置乙中盛放的试剂为浓硫酸,装置丁的作用是防止空气中的二氧化碳和水蒸气进入丙中.
②学习小组通过测量丙装置实验前后的质量.确定二氧化碳的质量.实验中滴加稀硫酸的速度过快,产生的气流过急.会导致测得样品中碳酸钠的质量分数偏低(填写“偏高”“偏低”或“不变”).
(3)测氯化钠法.请你完成下列实验方案:称取一定质量的样品放入烧杯中加水溶解:加入足量稀硝酸,再加入足量的硝酸银溶液;
过滤、洗涤、干燥、称量沉淀的质量;计算出氯化钠的质量,再得样品中碳酸钠的质量分数.
分析 (1)②钡离子能和碳酸根离子结合生成白色沉淀;
④根据白色沉淀碳酸钡的质量可以求出碳酸钠的质量,进一步可以求出样品中碳酸钠的质量分数;
(2)装置分析可知,含NaCl杂质中碳酸钠质量分数的测定,利用稀硫酸和样品反应生成二氧化碳,通过装置乙干燥二氧化碳,通过丙装置吸收二氧化碳,称重得到生成二氧化碳的质量,计算样品中碳酸钠质量分数,丁装置是防止空气中的二氧化碳进入装置丙,引起测定误差,
①浓硫酸具有吸水性,碱石灰能够吸收水和二氧化碳;
②如果气流过急,则二氧化碳不容易完全吸收;
(3)硝酸银能和氯化钠反应生成白色沉淀氯化银.
解答 解:(1)②证明反应后BaCl2剩余的方法是:静置,取少量上层清液滴加碳酸钠溶液,有白色沉淀生成,证明氯化钡剩余.
故填:静置,取少量上层清液滴加碳酸钠溶液,有白色沉淀生成,证明氯化钡剩余;
④mg沉淀是碳酸钡,
设碳酸钠的质量为X,
Na2CO3+BaCl2=BaCO3↓+2NaCl,
106 197
X mg
X=$\frac{106m}{197}$g
样品中碳酸钠的质量分数为:$\frac{106m}{197w}$×100%,
故答案为:$\frac{106m}{197w}$×100%,
(2)①二氧化碳进入氢氧化钠溶液前应该除去水,浓硫酸具有吸水性,可以用浓硫酸除去二氧化碳中的水,为了防止空气中的二氧化碳和水蒸气影响实验结果,可以用碱石灰进行吸收.
故答案为:浓硫酸,防止空气中的二氧化碳和水蒸气进入丙中.
②实验中滴加稀硫酸的速度过快,产生的气流过急,二氧化碳不能完全被氢氧化钠溶液吸收,导致测得样品中碳酸钠的质量分数偏低.
故答案:偏低.
(3)稀硝酸和碳酸钠反应能生成硝酸钠、水和二氧化碳,硝酸银和氯化钠反应能生成氯化银沉淀和硝酸钠,加入稀硝酸是为了把碳酸钠除去.
故答案:加入足量稀硝酸,再加入足量的硝酸银溶液.
点评 本题考查了根据化学方程式进行计算时,要注意规范性,计算要准确,化学方程式要注意遵循质量守恒定律,即配平,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 醋酸与锌反应放出氢气多 | |
| B. | 醋酸与锌反应速率小 | |
| C. | 盐酸和醋酸分别与锌反应放出的氢气一样多 | |
| D. | 盐酸和醋酸分别与锌反应的速率一样大 |
 羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:
羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:

芳香族反应试剂、产物的物理常数:
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
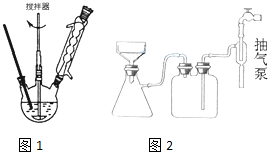
图1回流搅拌装置
图2抽滤装置
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
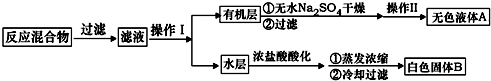
(1)无色液体A的结构简式为
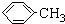 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol.产品中苯甲酸质量分数为96%.
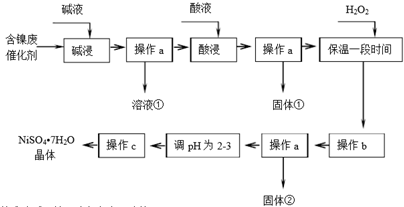
几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.
双氧水可以用下列物质替代的是A.
A.氧气 B.漂液 C.氯气 D.硝酸
(3)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.固体②的化学式为Fe(OH)3.
(4)操作a和c需要共同的玻璃仪器是玻璃棒.上述流程中,防止浓缩结晶过程中Ni2+水解的措施是保持溶液呈酸性.
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾.
设计实验证明产品中是否含“杂质”:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有Fe2+.(不考虑硫酸镍影响)
(6)取2.0000g硫酸镍晶体样品溶于蒸馏水,用0.2mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.滴定反应为Ni2++H2Y2-=NiY2-+2H+.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
| A. | CO2或SO2都会导致酸雨的形成 | |
| B. | 苯与溴水在铁催化下可发生取代反应 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 电解水生成H2和O2的实验中,可加入少量盐酸增强导电性 |
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为2CuFeS2+4O2═Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为2Cu2S+3O2═2Cu2O+2SO2;2Cu2O+Cu2S═6Cu+SO2↑;
④电解精炼铜.
下列说法正确的是( )
| A. | 冶炼过程中的尾气可用来制硫酸 | |
| B. | 上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g |

 ;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用饱和食盐水来代替水.
;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用饱和食盐水来代替水.