题目内容
5.重庆市天原化工厂2006年4月16日发生特大氯气泄漏和三氯化氮爆炸事故,造成多人死亡和失踪.已知三氯化氮分子结构与氨相似,下列有关说法不正确的是( )| A. | 消除储气罐上空泄漏出的高浓度氯气,可喷洒碱液 | |
| B. | 发生氯气泄漏时,附近人员可用浸有碳酸钠溶液的毛巾捂住鼻孔进行自我保护 | |
| C. | 氯气能腐蚀金属及非金属材料,这种腐蚀主要属于电化学腐蚀 | |
| D. | 三氯化氮分子是极性分子 |
分析 A、氯气是酸性气体,能够与碱溶液反应;
B、碳酸钠溶液水解显碱性;
C、氯气能腐蚀金属和非金属材料,是直接和金属或非金属反应;
D、三氯化氮和氨气分子结构类似,呈三角锥形,分子中存在N-Cl极性键,分子结构不对称,为极性分子.
解答 解:A、氯气是酸性气体,能够与碱溶液反应,所以有大量的氯气泄漏时,可在现场喷洒碱溶液,故A正确;
B、碳酸钠是强碱弱酸盐,其溶液水解显碱性,故能吸收氯气,故B正确;
C、氯气能腐蚀金属和非金属材料,是直接和金属或非金属反应,没有形成原电池,故为化学腐蚀,故C错误;
D、NCl3分子呈三角锥形,存在的N-Cl为极性键,分子结构不对称,为极性分子,故D正确.
故选C.
点评 本题以信息的形式考查极性分子和极性键以及物质的性质和危险的处理,明确信息并结合所学知识即可解答,题目难度不大.

练习册系列答案
相关题目
15.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1moLAl3+离子含有的电子数为3NA | |
| B. | 1moLCl2含有1NA个原子 | |
| C. | 78g过氧化钠固体中,含有1NA个阴离子 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L 水中 |
16.在相同条件下,下列各组中的物质按熔点由高到低排列的是( )
| A. | 硅晶体、食盐、干冰 | B. | 冰、石墨、金属钠 | ||
| C. | 碘、碳酸钙、金刚石 | D. | HF、HBr、HCl |
2.苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等.实验室合成苯甲酸的原理、有关数据及装置示意图如下:反应过程:
反应试剂、产物、副产物的物理常数:
注释:[1]100℃左右开始升华.
[2]苯甲酸在100g水中的溶解度为4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:按如图在250mL三颈瓶中放入2.7mL,甲苯和100mL水,控制100℃机械搅 拌溶液,在石棉网上加热至沸腾.
拌溶液,在石棉网上加热至沸腾.
分批加入8.5g高锰酸钾,继续搅拌约需4~5h,静置发现不再出现分层现象时,停止反应.装置a的作用是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.
写出并配平该反应化学方程式:
 +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$ +2 MnO2↓+H2O+1KOH
+2 MnO2↓+H2O+1KOH
Ⅱ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液充分反应,此时反应离子方程式为:OH-+HSO3-=SO32-+H2O、2MnO4-+3SO32-+H2O=2MnO2↓+3SO42-+2OH-.还可用乙二酸或者乙二酸钠有机化合物代替亚硫酸氢钠(填写名称).
(2)过滤洗涤.其目的是除去二氧化锰并回收二氧化锰表面附着的产品.
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在沸水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列BD操作(填入正确选项前的字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞;(填写“甲基橙”或“酚酞”).然后用标准浓度KOH溶液滴定,消耗KOH溶质的物质的量为2.40×10-3mol.产品中苯甲酸质量分数的计算表达式为$\frac{2.40×1{0}^{-3}×122×4}{1.22}$,计算结果为96.00%(保留两位有效数字).

反应试剂、产物、副产物的物理常数:
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
[2]苯甲酸在100g水中的溶解度为4℃,0.18g;18℃,0.27g;75℃,2.2g.
按下列合成步骤回答问题:
Ⅰ.苯甲酸制备:按如图在250mL三颈瓶中放入2.7mL,甲苯和100mL水,控制100℃机械搅
 拌溶液,在石棉网上加热至沸腾.
拌溶液,在石棉网上加热至沸腾.分批加入8.5g高锰酸钾,继续搅拌约需4~5h,静置发现不再出现分层现象时,停止反应.装置a的作用是将甲苯和水冷凝回流,防止甲苯的挥发而降低产品产率.
写出并配平该反应化学方程式:
 +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$ +2 MnO2↓+H2O+1KOH
+2 MnO2↓+H2O+1KOHⅡ.分离提纯:
(1)除杂.将反应混合物加入一定量亚硫酸氢钠溶液充分反应,此时反应离子方程式为:OH-+HSO3-=SO32-+H2O、2MnO4-+3SO32-+H2O=2MnO2↓+3SO42-+2OH-.还可用乙二酸或者乙二酸钠有机化合物代替亚硫酸氢钠(填写名称).
(2)过滤洗涤.其目的是除去二氧化锰并回收二氧化锰表面附着的产品.
(3)苯甲酸生成.合并实验(2)滤液和洗涤液,放在冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸全部析出.将析出的苯甲酸减压过滤,得到滤液A和沉淀物B.沉淀物B用少量冷水洗涤,挤压去水分,把制得的苯甲酸放在沸水浴上干燥,得到粗产品C.
(4)粗产品提纯.将粗产品C进一步提纯,可用下列BD操作(填入正确选项前的字母).
A.萃取分液 B.重结晶 C.蒸馏 D.升华
Ⅲ.产品纯度测定:称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞;(填写“甲基橙”或“酚酞”).然后用标准浓度KOH溶液滴定,消耗KOH溶质的物质的量为2.40×10-3mol.产品中苯甲酸质量分数的计算表达式为$\frac{2.40×1{0}^{-3}×122×4}{1.22}$,计算结果为96.00%(保留两位有效数字).
20.下列关于碱金属元素和卤素的说法中,错误的是( )
| A. | 随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 溴单质与H2的反应比碘单质与H2的反应更剧烈 |

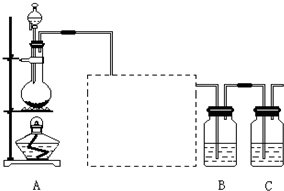
 有如图装置:回答下列问题:
有如图装置:回答下列问题: