题目内容
6.下列叙述错误的是( )| A. | 范德华力是普遍存在的一种分子间作用力,属于电性作用 | |
| B. | 范德华力比较弱,但范德华力越强,物质的熔点和沸点越高 | |
| C. | 氢键属于一种较强的分子间作用力,只能存在于分子之间 | |
| D. | 形成氢键时必须含有氢原子,另外氢原子两边的原子必须具有很强的电负性、很小的原子半径 |
分析 范德华力为电磁力的一种,相对较弱,影响物质的熔点、沸点,氢键属于分子间作用力,比范德华力较强,可存在于分子之间、分子之内,以此解答该题.
解答 解:A.范德华力为电磁力的一种,为分子间作用力,故A正确;
B.范德华力影响物质的熔点、沸点,范德华力越强,物质的熔点和沸点越高,故B正确;
C.氢键属于分子间作用力,可存在于分子之间、分子之内,故C错误;
D.氢键存在于电负性较强的元素形成的氢化物中,故D正确.
故选C.
点评 本题考查氢键、分子间作用力知识,为高频考点,侧重于学生的分析能力的考查,注意把握二者的区别,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
17.污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法;⑤降解法;⑥混凝法.其中属于化学方法的有( )
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ①②④⑤ | D. | ①②③⑥ |
14.下列各组物质所含化学键类型不同的是( )
| A. | NaCl和Na2S | B. | HCl和NH3 | C. | AlCl3和H2O | D. | CH4和Na2O |
1.巴伊亚祖母绿号称是世界上最大的祖母绿矿石,重380余公斤,含有约18万克拉的祖母绿宝石,价值约4亿美元.祖母绿的元素组成是O、Si、Al、Be,化学式为Be3Al2Si6O18.

(1)基态Al原子中,电子占据的最高能级的符号是3p,该能级具有的原子轨道数为3.
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图1),在1000℃,氯化铍则以BeCl2形式存在.在BeCl2分子中,Be的杂化方式为sp,二聚体Be2Cl4中Be的杂化方式为sp2,1mol Be2Cl4中含有2mol配位键.
(3)氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:
乙酸分子中σ键与π键数目之比为7:1,由表格中的数据知,乙酸的熔沸点均比乙醇高,原因是乙酸中羧基上的两个O原则均可形成氢键,比乙醇形成分子间氢键的概率大.
(4)如图2所示为Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度ρ=3.00g/cm3,则晶胞参数a=0.38nm.

(1)基态Al原子中,电子占据的最高能级的符号是3p,该能级具有的原子轨道数为3.
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图1),在1000℃,氯化铍则以BeCl2形式存在.在BeCl2分子中,Be的杂化方式为sp,二聚体Be2Cl4中Be的杂化方式为sp2,1mol Be2Cl4中含有2mol配位键.
(3)氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:
| 乙酸 | 乙醇 | |
| 熔点/℃ | 16.6 | -114.3 |
| 沸点/℃ | 117.9 | 78.4 |
(4)如图2所示为Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度ρ=3.00g/cm3,则晶胞参数a=0.38nm.
11. T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
 T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,将6mol CO2和8mol H2充入2L密闭恒容容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2 mol/(L•min) | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应放热反应 | |
| C. | 曲线Ⅱ对应的条件改变是降低压强 | |
| D. | 曲线Ⅱ对应的条件改变是加入催化剂 |
18.由几种离子化合物组成的混合物,含有以下离子中的若干种:
K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-.将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
试回答下列问题:
(1)根据实验A判断Cl-是否存在不能确定(填“一定存在”、“一定不存在”或“不能确定”).
(2)该混合物中一定不存在的离子是Ba2+、Mg2+.
(3)写出实验B中发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)混合物中是否存在K+,写出判断过程?
K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-.将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
| 实验序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27g,第二次称量沉淀质量为2.33g |
(1)根据实验A判断Cl-是否存在不能确定(填“一定存在”、“一定不存在”或“不能确定”).
(2)该混合物中一定不存在的离子是Ba2+、Mg2+.
(3)写出实验B中发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(4)混合物中是否存在K+,写出判断过程?
15.在CuCl2和MgCl2的混合溶液中,加入过量的铁粉,充分反应后过滤,留在滤纸上的物质是( )
| A. | Fe | B. | Cu | C. | Fe 和 Cu | D. | Cu 和 Cu |
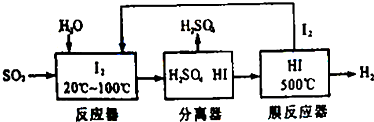
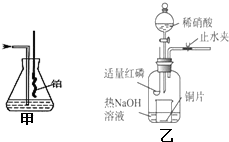 Ⅰ、实验室模拟氨催化氧化的装置如图甲:
Ⅰ、实验室模拟氨催化氧化的装置如图甲: