题目内容
20.用NA一表示阿伏加德罗常数的值.下列判断错误的是( )| A. | NA个H+的质量为1g | |
| B. | 32g O2中含有2NA个O原子 | |
| C. | 2 L 0.5mol/LNa2SO4溶液中含NA个Na+ | |
| D. | 标准状况下,1 molH2O中含有10NA个质子 |
分析 A、根据质量m=nM=$\frac{N}{{N}_{A}}M$来计算;
B、根据氧气由氧原子构成来计算;
C、求出Na2SO4的物质的量,然后根据1molNa2SO4含2mol钠离子来计算;
D、水为10电子、10质子微粒.
解答 解:A、氢离子的质量m=nM=$\frac{N}{{N}_{A}}M$=$\frac{{N}_{A}}{{N}_{A}}$×1g/mol=1g,故A正确;
B、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,故B正确;
C、Na2SO4的物质的量n=CV=0.5mol/L×2L=1mol,而1molNa2SO4含2mol钠离子,故C错误;
D、水为10电子、10质子微粒,故1mol水中含10mol质子,与水所处的状态无关,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
10.下列化学式只能表示一种物质的是( )
| A. | C3H8 | B. | C4H10 | C. | C4H8 | D. | C2H6O |
11.下列工业生产的主要反应中,涉及置换反应的是( )
| A. | 制取粗硅 | B. | 海水提镁 | C. | 电解制铝 | D. | 制备硫酸 |
8.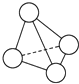 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )| A. | 1 mol N4气体转变为N2将放出775 kJ热量 | |
| B. | 1 mol N4气体转变为N2将放出882 kJ热量 | |
| C. | 1 mol N4气体转变为N2将吸收775 kJ热量 | |
| D. | 1 mol N4气体转变为N2将吸收882 kJ热量 |
15.第三周期元素中,基态原子轨道表示式中存在着空轨道的元素有( )种.
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
5.下列实验操作或叙述正确的是( )
| A. | 通过导电实验证明氢氧化铁胶体带正电 | |
| B. | 除去苯中溶有的少量乙醇,加入水,振荡,然后分液 | |
| C. | 进行蒸馏操作时.应用温度计准确测量沸腾液体的温度 | |
| D. | 从海带中提取碘时用到的药品有双氧水和NaOH溶液 |
9.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L(标准状况)二氧化碳和2.7g的水.下列说法中正确的是( )
| A. | 混合气体中一定含有乙烯 | |
| B. | 混合气体中一定含有甲烷 | |
| C. | 混合气体中一定含有乙炔 | |
| D. | 混合气体一定是由烷烃和烯烃构成的混合物 |
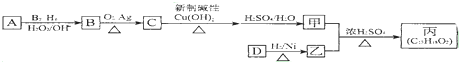
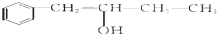
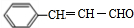
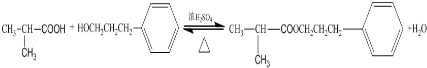 ,该反应类型为酯化反应:
,该反应类型为酯化反应: 实验室制取乙烯的装置如图所示,请回答:
实验室制取乙烯的装置如图所示,请回答: