题目内容
8.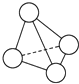 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )| A. | 1 mol N4气体转变为N2将放出775 kJ热量 | |
| B. | 1 mol N4气体转变为N2将放出882 kJ热量 | |
| C. | 1 mol N4气体转变为N2将吸收775 kJ热量 | |
| D. | 1 mol N4气体转变为N2将吸收882 kJ热量 |
分析 根据化学键断裂要吸收热量,形成化学键要放出热量,根据N4的分子结构,1molN4气体中含有6molN-N键,生成2molN2,形成2molN≡N键,据此计算出1molN4转变成N2的热效应.
解答 解:根据N4的分子结构,1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1moN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为2×942kJ=1884KJ,所以反应放热,放出的热量为1884KJ-1002KJ=882KJ,故应为放出882KJ热量,故B正确,
故选:B.
点评 本题考查反应热的计算,根据化学键断裂要吸收热量,形成化学键要放出热量判断,题目难度不大,注意基础知识的把握.

练习册系列答案
相关题目
18.有A、B两种烃,相关信息如下:
回答下列问题:
(1)烃A的最简式CH,结构简式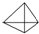
(2)烃B同一碳原子上的二溴取代物的结构简式CHBr2CH(CH3)2
(3)烃C为烃B的同系物,其碳原子数大于B但小于10,其一溴取代物只有一种,该烃的系统命名法名称可能为2,2,3,3-四甲基丁烷.
| A | ①28<M(A)<60 ②不能使溴的四氯化碳溶液褪色 ③其一氯取代物只有一种 ④完全燃烧产物中CO2和H2O物质的量之比2:1 |
| B | ①饱和链烃,通常情况下呈气态 ②有同分异构体 ③其二溴取代物有三种 |
(1)烃A的最简式CH,结构简式

(2)烃B同一碳原子上的二溴取代物的结构简式CHBr2CH(CH3)2
(3)烃C为烃B的同系物,其碳原子数大于B但小于10,其一溴取代物只有一种,该烃的系统命名法名称可能为2,2,3,3-四甲基丁烷.
19.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质( )
| A. | 锌粉 | B. | 镁粉 | C. | 铁粉 | D. | 铝粉 |
16. 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
 往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )
往某恒温密闭容器中加入CaCO3,发生反应:CaCO3(s)?CaO(s)+CO2(g)△H>0.反应达到平衡后,t1时,缩小容器体积,x随时间(t)变化的关系如右图所示.x不可能是( )| A. | v逆 | B. | c(CO2) | C. | △H | D. | ρ(容器内气体密度) |
3.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
| A. | ①⑤ | B. | ①③⑤⑧ | C. | ②④⑥⑦ | D. | ②④⑥ |
20.用NA一表示阿伏加德罗常数的值.下列判断错误的是( )
| A. | NA个H+的质量为1g | |
| B. | 32g O2中含有2NA个O原子 | |
| C. | 2 L 0.5mol/LNa2SO4溶液中含NA个Na+ | |
| D. | 标准状况下,1 molH2O中含有10NA个质子 |
17.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 标准状况下,22.4 L氧气作氧化剂时转移电子数为4NA |
18.某有机物A是农药生产中的一种中间体,其结构简式如图.则下列叙述正确的是( )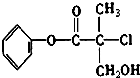

| A. | 有机物A分子式为C10H12O3Cl | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 1molA和足量的NaOH溶液反应,最多可以消耗3mol NaOH |
 .
.