��Ŀ����
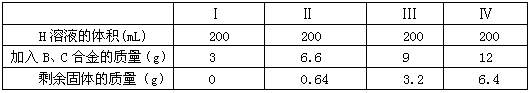
��֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ����
��ش��������⣺
��1��A�Ļ�ѧʽΪ______��
��2��A��Һ��Na2O2��Ӧ���ܻ�ѧ����ʽΪ______��
��3��E��ϡ��Һ��F��Һ��Ӧ�����ӷ���ʽΪ______��
��4�����100mL��A����Һһ��ʱ��Ͽ���·��ȡ���缫��������õ�������D�ڱ�״���µ����Ϊ5.6mL���������Һ��pHΪ______����������Һ������䣩
��5������100mL��A����Һ�м���10g��������B�ķ�ĩ����ֽ�����ˣ���ɵ�10.16g����C������Һ�����ʵ����ʵ���Ũ��Ϊ______����������Һ������䣩
��ش��������⣺
��1��A�Ļ�ѧʽΪ______��
��2��A��Һ��Na2O2��Ӧ���ܻ�ѧ����ʽΪ______��
��3��E��ϡ��Һ��F��Һ��Ӧ�����ӷ���ʽΪ______��
��4�����100mL��A����Һһ��ʱ��Ͽ���·��ȡ���缫��������õ�������D�ڱ�״���µ����Ϊ5.6mL���������Һ��pHΪ______����������Һ������䣩
��5������100mL��A����Һ�м���10g��������B�ķ�ĩ����ֽ�����ˣ���ɵ�10.16g����C������Һ�����ʵ����ʵ���Ũ��Ϊ______����������Һ������䣩

��1�����A��Һʱ������������C������һ������D��ӦΪ��⺬��������Һ�������������������ý�������CӦΪͭ��DΪ������E��Һ����C��������������ԭ��Ӧ����E��Һ��F��ҺҲ�ܷ�Ӧ������ɫ��ζ����G��˵��E��Һ����ǿ�����ԣ�ӦΪ���ᣬ��AΪ���ᣬCΪͭ��DΪ������GΪNO��F�����ᷴӦ����NO��˵���Һ��н���BԪ�أ�˵��F��Һ���л�ԭ�ԣ�ӦΪFe��NO3��2��Һ��BΪFe��HΪFe��NO3��3���ʴ�Ϊ��Cu��NO3��2��
��2��Na2O2��ˮ���뵽Cu��NO3��2��Һ�з�Ӧ����NaOH��������NaOH��Cu��NO3��2��Ӧ������ɫ����2Cu��OH��2���ʴ�Ϊ��2Na2O2+2Cu��NO3��2+2H2O=2Cu��OH��2��+4NaNO3+O2����
��3���������ǿ�����ԣ�Fe2+���л�ԭ�ԣ����߷���������ԭ��Ӧ���ʴ�Ϊ��3Fe2++NO3-+4H+�T3Fe3++NO��+2H2O��
��4�����ݵ������ͭ�ĵ缫����ʽ��
2Cu��NO3��2+2H2O
2Cu+O2��+4HNO3
22.4L 4mol
5.6��10-3L n
��n=
=1��10-3mol
����c��H+��=
=0.01mol����PH=2���ʴ�Ϊ��2��
��5������A��Һ�м����������B����Ӧ�Ļ�ѧ����ʽΪ��Fe+Cu��NO3��2�TFe��NO3��2+Cu�����ݲ��������㣺
Fe+Cu��NO3��2�TFe��NO3��2+Cu��m
1mol 8g
n 10.16g-10g=0.16g
n=
=0.02mol��������Һ��Ũ��Ϊ��
=0.2mol/L���ʴ�Ϊ��0.2 mol/L��
��2��Na2O2��ˮ���뵽Cu��NO3��2��Һ�з�Ӧ����NaOH��������NaOH��Cu��NO3��2��Ӧ������ɫ����2Cu��OH��2���ʴ�Ϊ��2Na2O2+2Cu��NO3��2+2H2O=2Cu��OH��2��+4NaNO3+O2����
��3���������ǿ�����ԣ�Fe2+���л�ԭ�ԣ����߷���������ԭ��Ӧ���ʴ�Ϊ��3Fe2++NO3-+4H+�T3Fe3++NO��+2H2O��
��4�����ݵ������ͭ�ĵ缫����ʽ��
2Cu��NO3��2+2H2O
| ||
22.4L 4mol
5.6��10-3L n
��n=
| 4��mol��5.6��10-3 |
| 22.4L L |
����c��H+��=
| 1��10-3mol |
| 0.1L |
��5������A��Һ�м����������B����Ӧ�Ļ�ѧ����ʽΪ��Fe+Cu��NO3��2�TFe��NO3��2+Cu�����ݲ��������㣺
Fe+Cu��NO3��2�TFe��NO3��2+Cu��m
1mol 8g
n 10.16g-10g=0.16g
n=
| 0.16 |
| 8 |
| 0.02mol |
| 0.1L |

��ϰ��ϵ�д�
�����Ŀ
 ��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ����
��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ����