题目内容
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.2molNa202和Na2S的混合物中共含有离子数目为0.6NA | |
| B. | 2.24LNz和足量Hz充分反应转移的电子数目为0.6NA | |
| C. | 含氢原子1.806×l024的甲基中含有的质子数为10NA | |
| D. | 1.0L1.0mol/LFeCI3溶液全部转化成氢氧化铁胶体所得胶粒数目为NA |
分析 A、Na202和Na2S均由2个阳离子和1个阴离子构成;
B、气体所处的状态不明确;
C、甲基中含3个氢原子,根据含有的氢原子的个数计算出甲基的个数,然后根据1个甲基中含9个质子来分析;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、Na202和Na2S均由2个阳离子和1个阴离子构成,故0.2mol混合物中含有0.6mol离子即0.6NA个,故A正确;
B、氮气所处的状态不明确,故其物质的量无法计算,且和氢气的反应为可逆反应,不能进行彻底,故转移的电子数无法计算,故B错误;
C、甲基中含3个氢原子,故含有的氢原子1.806×l024的甲基为6.02×1023个即1mol,而1个甲基中含9个质子,故1mol甲基中含质子为9mol即9NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.下列有关叙述中正碗的是( )
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |
15.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol/L CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol/LNaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10mol/L( NH4)2CO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) |
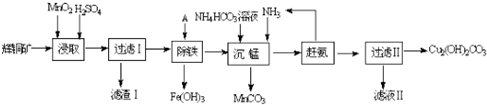
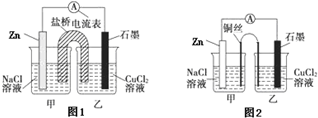
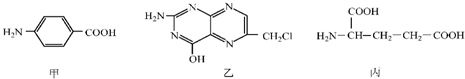
 .
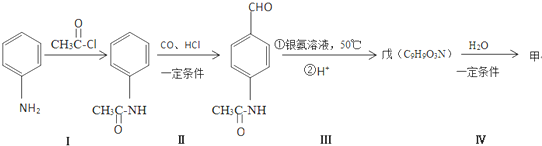
.
 .
. A、B、C、D、E五种元素的原子序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列同题.
A、B、C、D、E五种元素的原子序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列同题.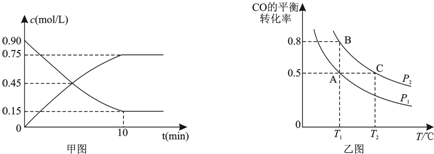

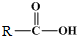 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$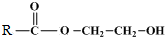
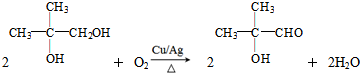 .
. .
.