题目内容
9.下列配制的溶液浓度偏高的是( )| A. | 配制稀盐酸用量筒量取浓盐酸时,俯视刻度线 | |
| B. | 用量筒量取所需的浓盐酸倒入烧杯后,再用水洗量筒2-3次,洗液倒入烧杯中 | |
| C. | 称量11.7 g NaCl配制0.2 mol/L NaCl溶液时,砝码错放在左盘 | |
| D. | 定容时仰视刻度线 |
分析 根据操作方法对c=$\frac{n}{V}$的影响分析误差,若n偏小、V偏大,则配制溶液浓度偏低,否则浓度偏高,据此进行解答.
解答 解:A.俯视量筒刻度线,导致量取的浓盐酸体积偏小,配制的溶液浓度偏低,故A错误;
B.量筒不能洗涤,否则配制的溶液中溶质的物质的量偏大,配制的溶液浓度偏高,故B正确;
C.称量氯化钠固体时,砝码错放在左盘,称量的氯化钠的质量偏小,配制的溶液浓度偏低,故C错误;
D.定容时仰视容量瓶刻度线,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,故D错误;
故选B.
点评 本题考查了配制一定物质的量浓度溶液的配制过程中的误差分析,题目难度不大,明确配制步骤为解答关键,根据c=$\frac{n}{V}$结合操作过程中的溶质的物质的量n和溶液的体积V的变化来分析,试题有利于提高学生的分析能力及化学实验能力.

练习册系列答案
相关题目
6.下列溶液肯定显酸性的是( )
| A. | 含H+的溶液 | B. | 能使酚酞显无色的溶液 | ||
| C. | pH<7的溶液 | D. | C(H+)>C(OH-)的溶液 |
4.下列离子组在强酸性溶液中能大量共存是( )
| A. | K+、Fe2+、NO3-、Cl- | B. | Na+、Fe3+、SCN-、SO42- | ||
| C. | K+、Na+、Cl-、AlO2- | D. | Al3+、Na+、C1-、SO42- |
4.下列叙述正确的是( )
| A. | 1 mol任何气体的体积都约为22.4L | |
| B. | 将1L 10 mol/L的浓盐酸与9L水混合时物质的量浓度为1 mol/L | |
| C. | 将22.4L氯化氢气体溶于水配成1L溶液时物质的量浓度为1 mol/L | |
| D. | 标准状况下,22.4L的任何气体的物质的量都是1 mol |
14.一块表面已被氧化为Na2O的钠块7.7g,将其投入100g水中,产生H2的质量为0.2g,则被氧化的钠是( )
| A. | 9.2 g | B. | 10.6 g | C. | 6.2 g | D. | 2.3 g |
18.物质的量均为1mol的下述物质①氧化钠②过氧化钠③氢氧化钠④亚硫酸钠,长期放置于空气中(最终物质不考虑潮解情况),最后质量增加的大小关系是( )
| A. | ①=③>②>④ | B. | ①>②>④>③ | C. | ③>①=②>④ | D. | ④>③>②>① |

 .
.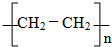 反应类型:加聚反应.
反应类型:加聚反应.