题目内容
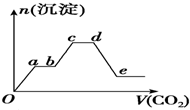 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是( )| A、Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
| B、ab段与cd段所发生的反应相同 |
| C、de段沉淀减少是由于BaCO3固体消失的 |
| D、bc段反应的离子方程式是2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- |
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:只要通入CO2,立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=Ba CO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,沉淀量达最大后,再发生CO32-+CO2+H2O=HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,沉淀部分溶解,以此来解答.
解答:
解:只要通入CO2,立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=Ba CO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,沉淀量达最大后,再发生CO32-+CO2+H2O=HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,沉淀部分溶解,
A.由上述分析可知,Oa发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,故A正确;
B.由上述分析可知,ab段发生2OH-+CO2═CO32-+H2O,cd段发生CO32-+CO2+H2O=HCO3-,两阶段反应不相同,故B错误;
C.de段发生反应BaCO3+CO2+H2O=Ba(HCO3)2,导致沉淀的减少,故C正确;
D.由上述分析可知,bc段反应的离子方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,故D正确;
故选B.
A.由上述分析可知,Oa发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,故A正确;
B.由上述分析可知,ab段发生2OH-+CO2═CO32-+H2O,cd段发生CO32-+CO2+H2O=HCO3-,两阶段反应不相同,故B错误;
C.de段发生反应BaCO3+CO2+H2O=Ba(HCO3)2,导致沉淀的减少,故C正确;
D.由上述分析可知,bc段反应的离子方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,故D正确;
故选B.
点评:本题以图象题形式考查反应先后顺序问题,为高频考点,侧重对基础知识的综合考查,把握元素化合物性质及发生的反应、图象与反应的对应关系是关键的关键,题目难度中等.

练习册系列答案
相关题目
在下列实验操作中错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计的水银球在蒸馏烧瓶的支管口处 |
| C、过滤时,玻璃棒在引流过程中应放在三层滤纸处 |
| D、称量时,称量物放在称量纸上,置于托盘天平左盘,砝码直接放在托盘天平右盘 |
下列物质中,与化合物C2H6互为同系物的是( )
| A、C4H10 |
| B、C2H4 |
| C、C3H6 |
| D、C6H6 |
把Na投入CuSO4溶液中可能出现的现象是( )
①生成红色的物质 ②有气体生成 ③熔成小球 ④生成蓝色沉淀.
①生成红色的物质 ②有气体生成 ③熔成小球 ④生成蓝色沉淀.
| A、①③④ | B、②③④ |
| C、①④ | D、①③④ |
设阿伏加德常数为NA.则下列说法正确的是( )
| A、常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
| B、标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA |
| C、常温常压下,18g H2O中含有的电子数为3NA |
| D、常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |