题目内容
5.下列关于指定粒子的叙述中,错误的是( )| A. | 37C l与39K的中子数不等 | B. | 12C与14C的质子数相等 | ||
| C. | H3O+与OH-的电子数相等 | D. | 15N2与14N2摩尔质量不等 |
分析 A.质量数=质子数+中子数;
B.同位素的质子数相同;
C.阳离子的电子数=质子数-电荷数,阴离子的电子数=质子数+电荷数;
D.摩尔质量在数值上等于相对分子质量.
解答 解:A.37Cl中中子数=37-17=20,39K中中子数=39-19=20,则二者所含的中子数相同,故A错误;
B.12C和14C是不同的核素,属于同种元素的同位素,所以质子数相等,故B正确;
C.H3O+的质子数为11,电子数为10,OH-的质子数为9和电子数为10,所以二者的电子相同,故C正确;
D.15N2与14N2摩尔质量分别为30g/mol、28g/mol,二者摩尔质量不等,故D正确.
故选A.
点评 本题考查原子的构成及原子中的数量关系,把握同位素的判断及原子中质子数=电子数、质量数=质子数+中子数为解答的关键,注重基础知识的考查,题目较简单.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
15.(1)25℃,吸收液Na2SO3溶液在吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①当吸收液呈中性时,溶液中离子浓度关系正确的是:AB(选填字母)
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
②当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
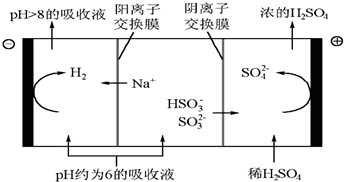
请写出HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
(2)已知:CH4(g)+2O2(g)=CO2 (g)+2H2O (l)△H=-Q1 kJ/mol
2H2(g)+O2(g)=2H2 O (g)△H=-Q2 kJ/mol
2H2(g)+O2(g)=2H2 O (l)△H=-Q3 kJ/mol,
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为0.4Q1+0.05Q3.
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
②当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

请写出HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
(2)已知:CH4(g)+2O2(g)=CO2 (g)+2H2O (l)△H=-Q1 kJ/mol
2H2(g)+O2(g)=2H2 O (g)△H=-Q2 kJ/mol
2H2(g)+O2(g)=2H2 O (l)△H=-Q3 kJ/mol,
常温下,取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复常温,放出的热为0.4Q1+0.05Q3.
13.聚对苯二甲酸乙二酯(  )简称PET,俗称“的确良”,是一种性能良好的树脂材料,常用于合成化学纤维.下列有关说法正确的是( )
)简称PET,俗称“的确良”,是一种性能良好的树脂材料,常用于合成化学纤维.下列有关说法正确的是( )
 )简称PET,俗称“的确良”,是一种性能良好的树脂材料,常用于合成化学纤维.下列有关说法正确的是( )
)简称PET,俗称“的确良”,是一种性能良好的树脂材料,常用于合成化学纤维.下列有关说法正确的是( )| A. | 合成PET的单体为对苯二甲酸和乙醇 | |
| B. | PET可通过缩聚反应获得 | |
| C. | 1mol对苯二甲酸最多可以与5mol氢气发生加成反应 | |
| D. | PET与  互为同分异构体 互为同分异构体 |
20.铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,其说明书部分内容摘录如下:
【规格】每片含琥珀酸亚铁0.1g
【适应症】用于缺铁性贫血症,预防及治疗用.
【贮藏】避光、密封、在干燥处保存.
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大

该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用.
(1)实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应).滴定过程发生如下反应,请补充完整:
5Fe2++1MnO4-+=1Mn2++5Fe3++4H2O.
(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是烧瓶(园底烧瓶)分液漏斗.(填名称)
(3)取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L-1的KMnO4溶液滴定,某同学设计了图2滴定方式(夹持部分略去),最合理的是b(填字母序号);若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率偏高(填偏高、偏低或不变).
(4)三次操作读数如下:
计算该“速力菲”补铁药品Fe2+的氧化率为16%.
【规格】每片含琥珀酸亚铁0.1g
【适应症】用于缺铁性贫血症,预防及治疗用.
【贮藏】避光、密封、在干燥处保存.
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大

该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用.
(1)实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应).滴定过程发生如下反应,请补充完整:
5Fe2++1MnO4-+=1Mn2++5Fe3++4H2O.
(2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是烧瓶(园底烧瓶)分液漏斗.(填名称)
(3)取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L-1的KMnO4溶液滴定,某同学设计了图2滴定方式(夹持部分略去),最合理的是b(填字母序号);若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率偏高(填偏高、偏低或不变).
(4)三次操作读数如下:
| 序号 | V初 | V末 | V标 |
| 1 | 0.10mL | 9.71mL | 9.61mL |
| 2 | 1.50mL | 11.09mL | 9.59mL |
| 3 | 0.50mL | 11.10mL | 11.60mL |
10.不粘锅内壁有聚四氟乙烯涂层,下列关于聚四氟乙烯的说法正确的是( )
| A. | 聚四氟乙烯的单体是不饱和烃 | |
| B. | 聚四氟乙烯中含有碳碳双键 | |
| C. | 聚四氟乙烯有固定熔点 | |
| D. | 四氟乙烯中既含有极性键又含有非极性键 |
17.对于X+Y(s)?Z的平衡体系,若增大压强,Y的平衡转化率增大,则X和Z可能的状态是( )
| A. | X为气态,Z为固态 | B. | X为固态,Z为气态 | C. | X为气态,Z为气态 | D. | X为固态,Z为固态 |
14.合成药物异搏定路线中某一步骤如图所示,下列说法正确的是( )


| A. | 物质X的分子式为C8H10O2 | |
| B. | 物质Y可以发生水解、加成和氧化反应 | |
| C. | 物质Z中所有原子有可能在同一平面内 | |
| D. | 物质X的同分异构体中含苯环且能水解的共有6种 |