题目内容
3.下列有关胶体的说法正确的是( )| A. | 分散质粒子直径介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体带有电荷 | |
| C. | 用聚光手电筒照射FeCl3溶液和Fe(OH)3胶体时,产生的现象相同 | |
| D. | Fe(OH)3难溶于水,因此可以用向煮沸的氢氧化钠溶液中滴加饱和三氯化铁溶液的方法制备氢氧化铁胶体 |
分析 A.分散质粒子直径在1nm~100nm之间的分散系属于胶体;
B.胶体能吸附电荷;
C.溶液无丁达尔效应,胶体有丁达尔效应;
D.氯化铁与氢氧化钠直接生成氢氧化铁沉淀,不生成胶体.
解答 解:A.分散质粒子直径介于10-9 m~10-7m之间的分散系称为胶体,故A正确;
B.胶体能吸附电荷,但是胶体本身不带电荷,故B错误;
C.溶液无丁达尔效应,胶体有丁达尔效应,可用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体,产生的现象不相同,故C错误;
D.实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和的氯化铁溶液,氯化铁与氢氧化钠直接生成氢氧化铁沉淀,故D错误;
故选A.
点评 本题考查胶体的性质,题目难度不大,注意溶液无丁达尔效应,胶体有丁达尔效应.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
18.下列离子方程式书写正确的是( )
| A. | 小苏打和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| D. | 氢氧化铝溶于强碱:Al(OH)3+OH-═AlO2-+2H2O |
15.下列反应的离子方程式,书写错误的是( )
| A. | 钠放入水中:Na+2H+=2Na++H2↑ | |
| B. | 铜粉放入硝酸银溶液里:Cu+2Ag+=Cu2++2Ag | |
| C. | 氢氧化钡跟硫酸铜溶液的反应:Ba2++2OH-+Cu2++SO2-4=BaSO4↓+Cu(OH)2↓ | |
| D. | 氯化铁溶液中滴加硝酸银溶液:Cl-+Ag+=AgCl↓ |
12.为测定空气中CO2含量,做下述实验:
(1)为配置标准溶液,请选取必需的一组仪器B;
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
A、①②⑤⑥B、②④⑤⑥⑦C、①②⑥⑦D、②④⑤⑥
(2)滴定操作时,左手控制酸式滴定管活塞,眼睛注视液滴下滴速度和锥形瓶中溶液颜色的变化;
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤.需过滤的原因是除去BaCO3沉淀,使滤液只含Ba(OH)2,以保证实验成功;
(4)由实验数据算出空气中CO2的体积分数为0.025%;
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即更换溶液,进行第二次滴定,导致实验数据值(填偏高、偏低或无影响)偏高.
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收空气中的CO2 | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
A、①②⑤⑥B、②④⑤⑥⑦C、①②⑥⑦D、②④⑤⑥
(2)滴定操作时,左手控制酸式滴定管活塞,眼睛注视液滴下滴速度和锥形瓶中溶液颜色的变化;
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤.需过滤的原因是除去BaCO3沉淀,使滤液只含Ba(OH)2,以保证实验成功;
(4)由实验数据算出空气中CO2的体积分数为0.025%;
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即更换溶液,进行第二次滴定,导致实验数据值(填偏高、偏低或无影响)偏高.
20.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同),原子结构示意图为 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: .
.
(3)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)表示①与⑦的化合物的电子式 ,该化合物是由极性(填“极性”、“非极性”)键形成的.
,该化合物是由极性(填“极性”、“非极性”)键形成的.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
(6)元素③的氢化物的结构式为H-O-H;该氢化物常温下和元素⑦的单质反应的化学方程式为Cl2+H2O═HClO+HCl.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”、“非极性”)键形成的.
,该化合物是由极性(填“极性”、“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
(6)元素③的氢化物的结构式为H-O-H;该氢化物常温下和元素⑦的单质反应的化学方程式为Cl2+H2O═HClO+HCl.
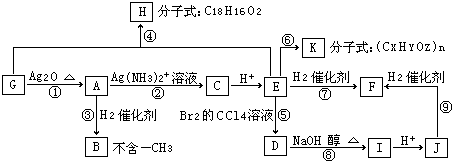
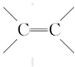 .
.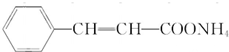 .物质K的结构简式
.物质K的结构简式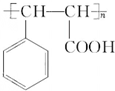 .
.
 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: