题目内容
2.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )| A. | 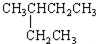 2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. | 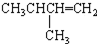 2-甲基丁烯 2-甲基丁烯 | D. | 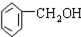 苯甲醇 苯甲醇 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.烷烃命名时,要选最长的碳链为主链,该命名选取的主链不是最长碳链,正确命名为3-甲基戊烷,故A错误;
B.CH3-CHBr2 二溴乙烷,该命名没有指出溴原子的位置,该有机物正确命名为:1,2-二溴乙烷,故B错误;
C.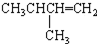 2-甲基丁烯,烯烃的命名中,编号应该从距离碳碳双键最近的一端开始,碳碳双键在1号C,甲基在2号C,该有机物的正确命名为:2-甲基-1-丁烯,故C错误;
2-甲基丁烯,烯烃的命名中,编号应该从距离碳碳双键最近的一端开始,碳碳双键在1号C,甲基在2号C,该有机物的正确命名为:2-甲基-1-丁烯,故C错误;
D.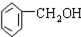 该有机物中-OH在苯环侧链上,故为醇,且侧链上有一个C原子,故为苯甲醇,故选D正确.
该有机物中-OH在苯环侧链上,故为醇,且侧链上有一个C原子,故为苯甲醇,故选D正确.
故选D.
点评 本题考查有机物的命名判断,题目难度中等,该题侧重对学生基础知识的检验和训练,关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力及灵活应用所学知识的能力.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
12.下列条件下的反应,放出H2的速率最快的是( )
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 1.5mol/L H2SO4 | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Zn | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Fe | 0.1 | 3mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
17.下列关于有机物的叙述正确的是( )
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 乙烯和聚乙烯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol苯分子中含有碳碳双键数为3NA | |
| D. | 要检验溴乙烷中的溴元素,可加入Na0H溶液共热一会儿,冷却后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
7.下列用以表示原电池或电解池中物质变化的化学用语中,不正确的是( )
| A. | 钢铁发生电化学腐蚀的负极反应式是Fe-2e-═Fe2+ | |
| B. | 甲醇燃料电池在碱性介质中的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 分别用铁棒作阳极、碳棒作阴极电解氯化铜溶液的离子方程式为:2Cl-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Cu↑+Cl2↑ | |
| D. | 电解熔融氯化镁时,阳极的电极反应式为2Cl--2e-═Cl2↑;阴极的电极反应式为Mg2++2e-═Mg |
11.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
| A. | 镁片作为负极 | B. | 正极发生氧化反应 | ||
| C. | 电池工作时镁片逐渐被消耗 | D. | 食盐水作为电解质溶液 |
12.某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、铝粉、钠、新制的Na2S溶液,新制的氯水,0.5mol/L的盐酸,3mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:
请回答下列问题:
(1)实验③的现象是生成淡黄色沉淀,该反应的离子方程式为S2-+Cl2=2Cl-+S↓.
(2)由实验③得出的实验结论是氯原子的得电子能力比硫原子强.
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确并说明原因否;浓度、接触面积等外界因素也影响着化学反应速率.
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
(1)实验③的现象是生成淡黄色沉淀,该反应的离子方程式为S2-+Cl2=2Cl-+S↓.
(2)由实验③得出的实验结论是氯原子的得电子能力比硫原子强.
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)实验④中,因为铝粉消失所用的时间短,因此,该同学得出结论:铝比镁易失电子,该结论是否正确并说明原因否;浓度、接触面积等外界因素也影响着化学反应速率.
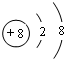 ,D在元素周期表中的位置第二周期VIA族.
,D在元素周期表中的位置第二周期VIA族.  .
.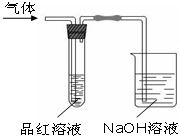 某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.