题目内容
6.已知:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ•mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
| A. | 1:1 | B. | 2:3 | C. | 1:4 | D. | 1:3 |
分析 混合气体物质的量=$\frac{112L}{22.4L/mol}$=5mol,设氢气、甲烷的物质的量,根据氢气、甲烷完全燃烧放出的热量列方程式组计算氢气与甲烷的物质的量,从而得出二者物质的量之比.
解答 解:混合气体物质的量=$\frac{112L}{22.4L/mol}$=5mol,设氢气、甲烷的物质的量分别是xmol、ymol,
根据方程式知,氢气、甲烷完全燃烧放出的热量分别是285.8xkJ、890ykJ,
列方程式组为$\left\{\begin{array}{l}{x+y=5}\\{285.8x+890y=3695}\end{array}\right.$
解得x=1.25,y=3.75,
原混合气体中H2与CH4的物质的量之比是1.25mol:3.75mol=1:3,故选D.
点评 本题考查混合物的有关计算,根据混合物的物质的量、混合物完全反应放出的热量列方程组解答即可,题目难度不大.

练习册系列答案
相关题目
16.下列化合物的一氯代物有三种的是( )
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,4-三甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
14.下列离子方程式正确的是( )
| A. | 铜片加入稀盐酸中:Cu+2H+=Cu2++H2↑ | |
| B. | 盐酸滴加在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-+Cu2++2 OH-=BaSO4↓+Cu(OH)2↓ |
11.水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
[1表示Pb2+、2表示Pb(OH)+、3表示Pb(OH)2、4表示Pb(OH)3-、5表示Pb(OH)42-]
(1)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子除H+、Na+外,还有:Pb2+、Pb(OH)+.
(2)pH=9时主要反应的离子方程式是:Pb(OH)++OH-?Pb(OH)2↓
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
上表中除 Pb2+外,该脱铅剂对其他离子的去除效果最好的是:Fe3+
(4)如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+
则脱铅最合适的pH范围为B(填代码).
A.4~5 B.6~7 C.9~10 D.11~12.
[1表示Pb2+、2表示Pb(OH)+、3表示Pb(OH)2、4表示Pb(OH)3-、5表示Pb(OH)42-]
(1)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液存在的阳离子除H+、Na+外,还有:Pb2+、Pb(OH)+.
(2)pH=9时主要反应的离子方程式是:Pb(OH)++OH-?Pb(OH)2↓
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度(mg/L) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度(mg/L) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(4)如该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+
则脱铅最合适的pH范围为B(填代码).
A.4~5 B.6~7 C.9~10 D.11~12.

1.下列各组物质中,化学键类型和化合物类型都相同的是( )
| A. | CO2和Na2CO3 | B. | SO2和H2O | C. | KOH和NaCl | D. | NaCl和HCl |
 .
.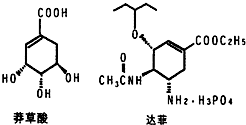 目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).
目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).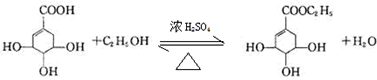 .
. .
.