题目内容
同在室温下,同种规格的铝片分别与下列溶液混合,反应速率最大的是( )
| A、0.2mol/L的盐酸15ml |
| B、0.2mol/L的盐酸12ml |
| C、0.25mol/L的硫酸12ml |
| D、18.4 mol/L浓硫酸15ml |
考点:化学反应速率的影响因素,化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:铝在浓硫酸中发生钝化,不能生成氢气,与其它酸反应本质为2Al+6H+=2Al3++3H2↑,反应开始H+浓度越大,反应越快,以此解答.
解答:
解:A.0.2 mol?L-1的盐酸中H+浓度为0.2mol/L;
B.0.2 mol?L-1的盐酸中H+浓度为0.2mol/L;
C.0.25mol/L的硫酸H+浓度为0.5mol/L;
D.铝在浓硫酸中发生钝化反应而不能生成氢气;
故A、B、C三者中C中氢离子浓度最大,三者比较C的反应速率最大,
故选C.
B.0.2 mol?L-1的盐酸中H+浓度为0.2mol/L;
C.0.25mol/L的硫酸H+浓度为0.5mol/L;
D.铝在浓硫酸中发生钝化反应而不能生成氢气;
故A、B、C三者中C中氢离子浓度最大,三者比较C的反应速率最大,
故选C.
点评:本题考查化学反应速率影响因素,题目难度不大,本题注意浓硫酸与铝发生钝化的性质.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
 “达菲”瑞士罗氏制药公司生产的一种治疗禽流感和甲型H1N1流感(猪流感)的特效药.达菲的主要有效成分莽草酸是从中国百姓常见的调味料八角茴香中提取出来的.莽草酸的结构式如图,下列说法正确的是( )
“达菲”瑞士罗氏制药公司生产的一种治疗禽流感和甲型H1N1流感(猪流感)的特效药.达菲的主要有效成分莽草酸是从中国百姓常见的调味料八角茴香中提取出来的.莽草酸的结构式如图,下列说法正确的是( )| A、它的分子式为C7H7O5 |
| B、遇FeCl3溶液呈紫色 |
| C、它不能发生消去反应 |
| D、1mol莽草酸跟足量的钠反应可以得到2molH2 |
关于2mol一氧化碳的叙述中,正确的是( )
| A、质量为28g |
| B、质量为56g |
| C、分子数为6.02×1023 |
| D、有2mol原子 |
能证明碳酸的酸性比硅酸强的事实是( )
| A、CO2溶于水生成碳酸,SiO2不溶于水也不能与水直接反应生成硅酸 | ||||
B、在高温下,SiO2和Na2CO3能发生反应:SiO2+Na2CO3
| ||||
| C、SiO2熔点比CO2高 | ||||
| D、CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀 |
用铁片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是( )
| A、加热 |
| B、不用稀硫酸,改用98%浓硫酸 |
| C、加水稀释硫酸 |
| D、不用铁片,改用铁粉 |
现有苯酚的乙醇溶液,若从该溶液中回收苯酚,可供选用的操作有:
①加适量盐酸;②蒸馏;③过滤;④分液;⑤加足量的NaOH溶液;⑥加足量的FeCl3溶液;⑦加适量的乙醇和浓硫酸混合液;⑧加足量的浓溴水;⑨加热;⑩通入过量的CO2.
正确的操作步骤是( )
①加适量盐酸;②蒸馏;③过滤;④分液;⑤加足量的NaOH溶液;⑥加足量的FeCl3溶液;⑦加适量的乙醇和浓硫酸混合液;⑧加足量的浓溴水;⑨加热;⑩通入过量的CO2.
正确的操作步骤是( )
| A、⑦⑨② | B、⑧③①② |
| C、⑥②①④ | D、⑤②⑩④ |
下列不属于合成纤维的是( )
| A、的确良 | B、棉花 |
| C、人造棉花 | D、氯纶 |
下列说法中正确的是( )
| A、分子的形状BF3与BCl3全等 |
| B、分子的形状CHCl3与CH3Cl全等 |
| C、CCl4与C2H6分子中心原子原子轨道杂化的方式相同 |
| D、BF3与NF3分子中心原子原子轨道杂化的方式相同 |
| E、BF3与NF3分子中心原子原子轨道杂化的方式相同 |
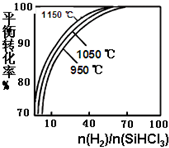 粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;