题目内容
10.某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:
□MnO2+□FeS+□H2SO4---□MnSO4+Fe2(SO4)3+□S+□H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.
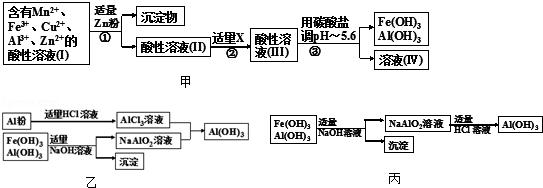
a、操作①中加Zn粉后发生反应的离子方程式为Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+.
b、操作②中加入适量X的作用是什么将Fe2+氧化成Fe3+;X的首选物的化学式是:MnO2.
c、操作③中所加碳酸盐的化学式是MnCO3或ZnCO3 或MnCO3和ZnCO3.
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓.
若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为$\frac{3n}{4}$、$\frac{3n}{4}$.
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?如按丙流程,则得到同样n molAl(OH)3,消耗的NaOH、HCl的理论量分别为n mol,大于前流程的消耗量,相对而言,前流程更符合节约的原则.
分析 甲:以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2,将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液加入适量的锌粉过滤得到酸性溶液Ⅱ中锌离子、亚铁离子、铝离子、锰离子等,加入适量试剂X为MnO2氧化亚铁离子为铁离子,得到酸性溶液Ⅲ,加入MnCO3或ZnCO3 或MnCO3和ZnCO3调节溶液PH沉淀铁离子和铝离子,得溶液(IV),电解溶液(IV)即得MnO2和Zn,
乙:铝粉和适量盐酸反应生成氯化铝溶液,氢氧化铁和氢氧化铝加入适量氢氧化钠溶液过滤得到偏铝酸钠溶液,和氯化铝溶液混合生成氢氧化铝沉淀,
丙:氢氧化铝和氢氧化铁中加入适量氢氧化钠溶液,氢氧化铝溶解,过滤得到偏铝酸钠溶液,在溶液中加入适量盐酸生成氢氧化铝沉淀,
(1)配平化学方程式时,前后原子的种类和个数不变;
(2)a.锌可以Cu2+和Fe3+反应;
b.MnO2可将Fe2+氧化成Fe3+;
c.溶液中不能引入新的杂质离子;
(3)a.AlCl3溶液和NaAlO2溶液反应生成AI(OH)3; 由方程式可知生成4molAI(OH)3需要1molAl3+和3molAlO2-;
b.如按丙流程,则得到同样n molAl(OH)3,消耗的NaOH、HCl的理论量分别为n mol,大于前流程的消耗量,相对而言,前流程更符合节约的原则;
解答 解:(1)此反应的化学方程式为:3MnO2+2FeS+6H2SO4=3MnSO4+1Fe2(SO4)3+2S+6H2O,
故答案为:3;2;6;3;1;2;6;
(2)a.锌可以Cu2+和Fe3+反应,方程式为:Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+,
故答案为:Zn+Cu2+=Zn2++Cu; Zn+2Fe3+=Zn2++2Fe2+;
b.X是MnO2,MnO2可将Fe2+氧化成Fe3+,
故答案为:将Fe2+氧化成Fe3+; MnO2;
c.溶液中不能引入新的杂质离子,溶液中含有锰离子和锌离子,可加入MnCO3或ZnCO3 或MnCO3和ZnCO3,可调节pH值,又不引入新的杂质,
故答案为:MnCO3或ZnCO3 或MnCO3和ZnCO3;
(3)a.AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;由方程式可知生成4molAI(OH)3需要1molAl3+和3molAlO2-,即由铝单质生成1molAl3+需要3mol盐酸和由氢氧化铝与氢氧化钠反应生成3molAlO2-需要3mol氢氧化钠,即消耗的NaOH和HCl的理论量(mol)都为$\frac{3n}{4}$,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓; $\frac{3n}{4}$、$\frac{3n}{4}$;
b.如丙流程,则得到同样n molAl(OH)3,根据NaAlO2+4HCl=NaCl+AlCl3+2H2O,生成nmolmolAl(OH)3消耗的HCl的理论量分别为4n mol,大于前流程的消耗量,
故答案为:如按丙流程,则得到同样n molAl(OH)3,消耗的NaOH、HCl的理论量分别为n mol,大于前流程的消耗量,相对而言,前流程更符合节约的原则.
点评 本题考查了物质性质、物质制备、反应过程和分离提纯的方法,是一道综合题,题目难度中等,掌握铝三角相关的方程式是解题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向AlCl3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 用铜除去CuCl2 溶液中少量的FeCl3:Fe2++Cu═Fe3++Cu2+ |
| A. | 甲烷 | B. | 乙烯 | C. | 甲苯 | D. | SO2 |
| A. | ls22s22p63s23p3 | B. | 1s22s22p3 | C. | 1s22s2sp2 | D. | 1s22s22p63s23p4 |
①由同一种元素组成的物质是单质
②阴离子一定不含金属元素,阳离子一定含金属元素
③金属氧化物一定是碱性氧化物
④碱性氧化物一定是金属氧化物
⑤非金属氧化物一定是酸性氧化物
⑥酸性氧化物一定是非金属氧化物
⑦酸的元数不一定等于酸中的H原子数.
| A. | ①②④⑤⑦ | B. | ①③⑤④ | C. | ①②③⑤⑥ | D. | ③④⑤⑦ |
| A. | 短周期是指第1、2周期 | B. | 过渡元素全部是金属元素 | ||
| C. | 元素周期表有8个副族 | D. | IA族的元索全部是金属元素 |
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO32- |
| D | 向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 | 该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
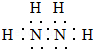 ,其中氮的化合价为-2.
,其中氮的化合价为-2.