题目内容
10.下列药品和装置合理且能完成相应实验的是( )| A. |  喷泉实验 | B. |  验证苯中是否含有碳碳双键 | ||
| C. |  制备氢氧化亚铁 | D. |  实验室制取并收集氨气 |
分析 A.一氧化氮气体不溶于水,无法形成喷泉实验;
B.碳碳双键不能与溴、酸性高锰酸钾溶液溶液反应;
C.氢氧化亚铁很容易被空气中氧气氧化,应该将胶头滴管的下端插入氯化亚铁溶液中;
D.加热固体,应防止试管炸裂.
解答 解:A.NO气体不与水反应,也难溶于水,无法形成压强差,则无法完成喷泉实验,故A错误;
B.苯中若含有碳碳双键,能够使溴水、酸性高锰酸钾溶液褪色,图示装置可验证苯中是否含有碳碳双键,故B正确;
C.氢氧化亚铁不稳定,易被氧气氧化而变质,制备氢氧化亚铁,应将胶头滴管插入液面以下,故C错误;
D.加热固体,试管口应略朝下倾斜,以防止试管炸裂,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及喷泉实验、氢氧化亚铁的制备、有机物的结构及气体的制备实验等知识,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
20.下列各组微粒中,核外电子排布相同的是( )
| A. | F-Cl -Na+ | B. | O2-S2-Cl- | C. | S2-Cl-Na+ | D. | Ne Mg2+Al3+ |
1.下列说法正确的是( )
| A. | 某酸性溶液中只含有Na+.CH3COO-.H+.OH-,向该溶液中加入适量氨水,c(CH3COO-)一定大于c(Na+)与 c(NH4+)之和 | |
| B. | 常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液.溶液中n(CH3COO-)+n(OH-)-n(H+)=0.006mol | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)<c(NO3-) | |
| D. | 物质的量浓度相等的NaF和NaCN溶液中阴离子总数相等 |
18.下列说法错误的是( )
| A. | s电子云是球状,而p电子云是哑铃状 | |
| B. | 同一能层中,p能级上的电子比s能级上电子能量高 | |
| C. | 能量高的电子在离原子核较近的区域运动 | |
| D. | 各能级最多容纳电子数是该能级原子轨道数的两倍,其理论依据是泡利不相容原理 |
15.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由下表中的离子形成:
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(2)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-.
(3)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(2)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-.
(3)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
2.“优先反应思想”是一条重要的化学学科思想.根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+
用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红
(2)用惰性电极电解由等物质的量的NaBr,KI,NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2
(3)己知常温下一些电解质的相关数据见表:
①向等物质的量浓度的Na2C03,CH3COONa,NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-
②向浓度均为0.010mot•L一1的NaCl,Na2Cr04组成的混合溶液中逐滴加入浓度为
0,.010mol•L -1AgN03溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100ML,浓度均为2mo1•L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为1:1.
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示)Fe3+、Fe2+、Cu2+.
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+
用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红
(2)用惰性电极电解由等物质的量的NaBr,KI,NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2
(3)己知常温下一些电解质的相关数据见表:
| H2CO3 | K${\;}_{{\;}_{{a}_{1}}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mot•L一1的NaCl,Na2Cr04组成的混合溶液中逐滴加入浓度为
0,.010mol•L -1AgN03溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100ML,浓度均为2mo1•L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示)Fe3+、Fe2+、Cu2+.
3.表是元素周期表的一部分,请回答有关问题:
(1)表中元素③是F(用元素符号表示),表中化学性质最不活泼的元素的原子结构示意图为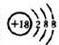 .
.
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(3)④元素与⑦元素形成的化合物的电子式 .
.
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填化学式)
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(3)④元素与⑦元素形成的化合物的电子式
 .
.(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填化学式)
 ;
; ;
; 和a个-CH3,其余为-OH,则-OH 的个数为m+2-a
和a个-CH3,其余为-OH,则-OH 的个数为m+2-a