题目内容
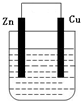
某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置.(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(填“锌”或“铜”,下同),溶液中的H+移向 极,铜极上的电极反应式是 .
(2)若电解质溶液是硫酸铜溶液,铜极上的电极反应式是 ,若反应过程中有0.2mol电子发生转移,则电解质溶液质量增加 g.
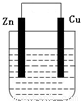
【答案】分析:(1)该装置是原电池,锌作负极,铜作正极,原电池放电时,电解质溶液中阳离子向正极移动,正极上得电子发生还原反应;
(2)当电解质溶液是硫酸铜溶液时,正极上铜得电子发生还原反应,根据溶液质量的增加量和转移电子之间的关系式计算.
解答:解:(1)该装置是原电池,锌失电子而作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;原电池放电时,氢离子向正极铜移动,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:锌,铜,2H++2e-=H2↑;
(2)该装置中,负极上锌失电子,正极上铜离子得电子生成铜,电极反应式为:Cu2++2e-=Cu;负极上锌变成锌离子进入溶液,正极上析出铜,所以溶液增加的质量=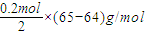 =0.1g,
=0.1g,
故答案为:Cu2++2e-=Cu,0.1.
点评:本题考查原电池,明确原电池正负极上电极反应是解本题关键,难度不大.
(2)当电解质溶液是硫酸铜溶液时,正极上铜得电子发生还原反应,根据溶液质量的增加量和转移电子之间的关系式计算.
解答:解:(1)该装置是原电池,锌失电子而作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;原电池放电时,氢离子向正极铜移动,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:锌,铜,2H++2e-=H2↑;
(2)该装置中,负极上锌失电子,正极上铜离子得电子生成铜,电极反应式为:Cu2++2e-=Cu;负极上锌变成锌离子进入溶液,正极上析出铜,所以溶液增加的质量=
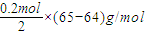 =0.1g,
=0.1g,故答案为:Cu2++2e-=Cu,0.1.
点评:本题考查原电池,明确原电池正负极上电极反应是解本题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置.
某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置.