题目内容
19.如图是元素周期表的部分框架,请回答下列问题:
(1)元素周期表中的元素⑤和元素⑥的最高价氧化物的水化物中酸性较强是H3PO4(填化学式),用电子式表示元素①与④的化合物的形成过程:
 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.(2)元素①~⑦中的某单质在常温下化学性质稳定,通常可以作保护气的是
 (填电子式).
(填电子式).(3)碳、氢两种元素能形成许多种化合物,有些分子还会形成同分异构体.写出与己烷互为同分异构体,且一氯代物有两种的化合物的结构简式并命名:CH3CH(CH3)CH(CH3)CH3,2,3二甲基丁烷.
分析 由元素在周期表的位置可知,①~⑦分别为H、N、O、F、Si、P、Cl,
(1)非金属性越强,最高价含氧酸的酸性越强;①与④的化合物为HF,为共价化合物;
(2)稀有气体性质稳定,可作保护气;
(3)与己烷互为同分异构体,且一氯代物有两种,则分子中含6个C,含2种H,以此来解答.
解答 解:由元素在周期表的位置可知,①~⑦分别为H、N、O、F、Si、P、Cl,
(1)非金属性越强,最高价氧化物的水化物的酸性越强,P的非金属性强于Si,则酸性较强的是H3PO4;①与④的化合物为HF,形成过程为 ,只含共价键,HF为共价化合物,
,只含共价键,HF为共价化合物,
故答案为:H3PO4; ;共价;
;共价;
(2)元素①~⑦中的某单质在常温下化学性质稳定,为氮气,常作保护气,其电子式为 ,
,
故答案为: ;
;
(3)与己烷互为同分异构体,且一氯代物有两种的化合物为2,3二甲基丁烷,结构简式为CH3CH(CH3)CH(CH3)CH3,
故答案为:CH3CH(CH3)CH(CH3)CH3;2,3二甲基丁烷.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识及化学用语的应用,题目难度不大.

练习册系列答案
相关题目
9.下列分子式只能表示一种物质的是( )
| A. | C3H6Cl2 | B. | C3H8 | C. | C2H6O | D. | C3H6 |
14.A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
(1)B元素符号为Al,A与C以原子个数比为1:1形成的化合物的电子式为 ,用电子式表示C与E形成化合物的过程
,用电子式表示C与E形成化合物的过程 ,D形成的简单离子的结构示意图为
,D形成的简单离子的结构示意图为 .
.
(2)F的氢化物是由极性(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)非金属性D小于E(填大于或小于),请从原子结构的角度解释原因:D的原子半径大于E的原子半径,所以得电子的能力比E弱.
| 元素 | 有关性质或结构信息 |
| A | 地壳中含量最多的元素 |
| B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
| E | E与D同周期,且在该周期中原子半径最小 |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
| G | G是形成化合物种类最多的元素 |
 ,用电子式表示C与E形成化合物的过程
,用电子式表示C与E形成化合物的过程 ,D形成的简单离子的结构示意图为
,D形成的简单离子的结构示意图为 .
.(2)F的氢化物是由极性(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)非金属性D小于E(填大于或小于),请从原子结构的角度解释原因:D的原子半径大于E的原子半径,所以得电子的能力比E弱.
1.在烷烃分子中,每增加一个碳原子,每摩尔该烷烃完全燃烧需要多消耗氧气( )
| A. | 1 mol | B. | 1.5 mol | C. | 2 mol | D. | 2.5 mol |
2.将盛有20mL NO和NO2混合气体的量筒倒立于水槽中,反应后气体体积缩小为15mL,则原混合气体中NO和NO2的体积比是( )
| A. | 4:1 | B. | 3:2 | C. | 5:3 | D. | 1:4 |
 3
3
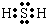 ;
;