题目内容
(每空4分,共12分)
(1)已知:TiO2(s)+2Cl2 (g)===TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)===2CO(g) Δ H=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式: 。
(2)在25℃,101KPa时,CO的燃烧热为280kJ/mol,写出 CO的燃烧热的热化学方程式: 。
(3)在火箭推进器中以肼(N2H4)作为燃料,可以选O2或NO2作为氧化剂,如果以氧气作为氧化剂,其化学反应与能量关系如下,

请写出该反应的热化学方程式
(1) TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1,
(2) CO(g)+1/2O2(g)=CO2(g) △H=-280kJ/mol
(3) N2H4(g)+ O2(g) =N2(g)+2H2O (g) △H=-534kJ/mol
【解析】
试题分析:(1)根据盖斯定律,一式加二式可得;TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1;(2)燃烧热是1mol物质完全燃烧生成稳定化合物时放出的热量,则CO的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g) △H=-280kJ/mol(3)根据图像可知,该反应是放热反应,反应的热化学方程式为N2H4(g)+ O2(g) =N2(g)+2H2O (g) △H=-534kJ/mol。
考点:考查热化学方程式的书写。

(19分) (1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知:H2S(g)  H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
H2(g)+1/2S2(g)ΔH在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。
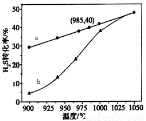
图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。ΔH_____0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因:________________________。
②电化学法:该法制氢过程的示意图如图。
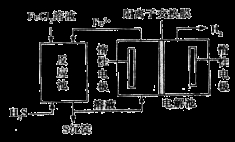
反应池中反应的离子方程式是_____________________________;
反应后的溶液进入电解池,电解总反应的离子方程式为___________________________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式__________________。②电池总反应的化学方程式__________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KMnO4溶液进行滴定,实验所得数据如下表所示;
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液的体积/ml | 20.60 | 20.02 | 20.00 | 19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液___________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗;
B.锥形瓶洗净后未干燥;
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
 2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为
2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为