题目内容
6.有5瓶溶液,它们分别是HCl、Na2CO3、NaHCO3、NaOH和Ca(HCO3)2的水溶液,为了鉴别它们,分别以A、B、C、D、E为代号,用它们进行以下实验,记录如下:A与B混合时无明显现象;B与C混合时有沉淀生成;B与D混合后生成了E;A能使石蕊试液变红.完成下列问题:(1)由此推知:AHCl;CCa(HCO3)2;ENa2CO3.
(2)写出B与 D反应生成E的离子方程式:HCO3-+OH-=H2O+CO32-
(3)少量C与B反应的离子方程式:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-.
分析 有5瓶溶液,它们分别是HCl、Na2CO3、NaHCO3、NaOH和Ca(HCO3)2的水溶液,A能使石蕊试液变红,则A呈酸性,为HCl;A与B混合时无明显现象,则B为NaOH;B与C混合时有沉淀生成,则C为Ca(HCO3)2;B与D混合后生成了E,则D为NaHCO3,E为Na2CO3,以此来解答.
解答 解:A能使石蕊试液变红,则A呈酸性,为HCl;A与B混合时无明显现象,则B为NaOH;B与C混合时有沉淀生成,则C为Ca(HCO3)2;B与D混合后生成了E,氢氧化钠与碳酸氢钠反应生成碳酸钠,则D为NaHCO3,E为Na2CO3,
(1)由上述分析可知,A为HCl,C为Ca(HCO3)2,E为Na2CO3,
故答案为:HCl;Ca(HCO3)2;Na2CO3;
(2)碳酸氢钠溶液与氢氧化钠溶液混合,反应生成碳酸钠和水,反应的离子反应为:HCO3-+OH-=H2O+CO32-,
故答案为:HCO3-+OH-=H2O+CO32-;
(3)C为Ca(HCO3)2,B为NaOH溶液,碳酸氢钙少量时,二者反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程是为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,
故答案为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列离子方程式的书写正确的是( )
| A. | 铁跟稀盐酸反应2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸氢钙溶液中加入盐酸Ca(HCO3)2+2HCl═CaCl2+H2O+CO2↑ | |
| C. | CO2通入足量石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | NaHCO3溶液中加入盐酸HCO3-+H+═H2CO3 |
17.可用于鉴别MgCl2和Al2(SO4)3两种溶液的试剂是( )
| A. | 氨水 | B. | H2SO4 | C. | NaOH溶液 | D. | HNO3溶液 |
14.下列有关NaClO和NaCl混合溶液的叙述正确的是( )
| A. | 该溶液中,H+、NH4+、Ag+可以大量共存 | |
| B. | 向该溶液中通入CO2,不发生化学反应 | |
| C. | 该溶液可作游泳池及环境的消毒剂,有效成分是NaCl | |
| D. | 常温下,将氯气通入NaOH溶液中可以得到该溶液 |
1.下列是某同学对相应反应的离子方程式所作的评价,其中对应的评价合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-═Mg(OH)2↓ | 正确 |
| B | 氧化铜与稀盐酸反应 | CuO+2H+═Cu2++H2O | 错误,不反应 |
| C | 向FeCl2溶液中通入氯气 | Fe2++Cl2═Fe3++2Cl- | 错误, 电荷不守恒 |
| D | 向沸水滴入饱和氯化铁溶液 | Fe3++3H2O$\frac{\underline{\;△\;}}{\;}$Fe(OH)3↓+3H+ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
18.下列溶液一定是碱性的是( )
| A. | pH=6的某电解质的溶液 | B. | c(OH-)>1×10-7mol/L | ||
| C. | 溶液中含有OH- | D. | 溶液中c(OH-)>c(H+) |
15.某学生配制一定物质的量浓度的NaOH溶液,下列可能导致溶液浓度偏低的是( )
| A. | 使用滤纸称量氢氧化钠固体 | B. | 溶解后未冷却直接定容 | ||
| C. | 容量瓶不干燥,存有少量蒸馏水 | D. | 胶头滴管加水定容时俯视刻度 |
16.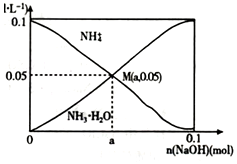 常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
 常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在 M 点时,n(OH- )-n(H+)=(a-0.05)mol | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c( NH4+)>c(OH-)>c(H+) | |
| D. | 随着NaOH的加入,一定存在c(Cl-)+c(0H-)+c(NH3•H20)>0.lmol•L-1 |
 ;
;