题目内容
按要求回答下列问题
(1)亚硝酸钠(NaNO2)外观酷似食盐,但它是一种有毒的物质.误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的.转化过程可表示为:Fe2+
Fe3+,转化1中,氧化剂是 ,转化2中,维生素C表现 性.
(2)在①盐酸、②浓硝酸、③氨水、④稀硫酸、⑤氢氧化钠溶液五种物质中,可用于除去Al表面的铜镀层的是 (填序号);实验室常用硫酸铝溶液和 (填序号)反应制取氢氧化铝,反应的离子反应方程式是 .
(3)把一定量铜粉投入氯化铁、氯化铜的混合溶液中,完全反应后,所得溶液中Cu2+、Fe2+和Fe3+三种离子的浓度恰好相等.则原溶液中的Fe3+和Cu2+的物质的量之比为 .
(1)亚硝酸钠(NaNO2)外观酷似食盐,但它是一种有毒的物质.误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的.转化过程可表示为:Fe2+
| 1NaNO2 |
| 2维生素C |
(2)在①盐酸、②浓硝酸、③氨水、④稀硫酸、⑤氢氧化钠溶液五种物质中,可用于除去Al表面的铜镀层的是
(3)把一定量铜粉投入氯化铁、氯化铜的混合溶液中,完全反应后,所得溶液中Cu2+、Fe2+和Fe3+三种离子的浓度恰好相等.则原溶液中的Fe3+和Cu2+的物质的量之比为
考点:氧化还原反应,铝的化学性质,铁盐和亚铁盐的相互转变
专题:
分析:(1)转化1中,Fe元素化合价由+2价变为+3价,则亚铁离子被氧化而作还原剂,亚硝酸钠作氧化剂;转化2中,Fe元素化合价由+3价变为+2价,铁元素得电子而作氧化剂,则维生素C作还原剂;
(2)在金属活动性顺序表中,Cu位于H之后,Cu和弱氧化性酸不反应,但能和强氧化性酸硝酸反应;氢氧化铝属于两性氢氧化物,能溶于强碱、强酸,应该用硫酸铝和弱碱反应制备氢氧化铝;
(3)Cu投入氯化铁、氯化铜的混合溶液中发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,所得溶液中Cu2+、Fe2+和Fe3+三种离子的浓度恰好相等,假设三种离子浓度都是2mol,根据方程式中各个物理量之间的关系式计算.
(2)在金属活动性顺序表中,Cu位于H之后,Cu和弱氧化性酸不反应,但能和强氧化性酸硝酸反应;氢氧化铝属于两性氢氧化物,能溶于强碱、强酸,应该用硫酸铝和弱碱反应制备氢氧化铝;
(3)Cu投入氯化铁、氯化铜的混合溶液中发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,所得溶液中Cu2+、Fe2+和Fe3+三种离子的浓度恰好相等,假设三种离子浓度都是2mol,根据方程式中各个物理量之间的关系式计算.
解答:
解:(1)转化1中,Fe元素化合价由+2价变为+3价,则亚铁离子被氧化而作还原剂,亚硝酸钠作氧化剂,体现氧化性;转化2中,Fe元素化合价由+3价变为+2价,铁元素得电子而作氧化剂,则维生素C作还原剂,维生素C体现还原性,故答案为:NaNO2;还原;
(2)在金属活动性顺序表中,Cu位于H之后,Cu和弱氧化性酸不反应,但能和强氧化性酸硝酸反应,Cu和碱溶液不反应,所以应该选择浓硝酸,且浓硝酸和Al发生钝化现象;氢氧化铝属于两性氢氧化物,能溶于强碱、强酸,应该用硫酸铝和弱碱反应制备氢氧化铝,所以应该选择氨水制备氢氧化铝,离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:②;③;Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(3)Cu投入氯化铁、氯化铜的混合溶液中发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,所得溶液中Cu2+、Fe2+和Fe3+三种离子的浓度恰好相等,假设三种离子浓度都是2mol,生成2mol亚铁离子需要2mol铁离子、同时生成1mol铜离子,则原来铁离子浓度为4mol、铜离子浓度为1mol,所以原溶液中的Fe3+和Cu2+的物质的量之比=4mol:1mol=4:1,故答案为:4:1.
(2)在金属活动性顺序表中,Cu位于H之后,Cu和弱氧化性酸不反应,但能和强氧化性酸硝酸反应,Cu和碱溶液不反应,所以应该选择浓硝酸,且浓硝酸和Al发生钝化现象;氢氧化铝属于两性氢氧化物,能溶于强碱、强酸,应该用硫酸铝和弱碱反应制备氢氧化铝,所以应该选择氨水制备氢氧化铝,离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:②;③;Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(3)Cu投入氯化铁、氯化铜的混合溶液中发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,所得溶液中Cu2+、Fe2+和Fe3+三种离子的浓度恰好相等,假设三种离子浓度都是2mol,生成2mol亚铁离子需要2mol铁离子、同时生成1mol铜离子,则原来铁离子浓度为4mol、铜离子浓度为1mol,所以原溶液中的Fe3+和Cu2+的物质的量之比=4mol:1mol=4:1,故答案为:4:1.
点评:本题考查氧化还原反应,涉及氧化还原计算、氧化性和还原性判断、离子方程式的书写等知识点,侧重考查基本理论,知道氢氧化铝的制备方法、氧化还原反应的计算方法,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下列各组离子能在(H+)=0.1mol/L的无色溶液中大量共存的是( )
| A、Ba2+、Na+、NO3-、MnO4- |
| B、Mg2+、Cl-、Na+、SO42- |
| C、K+、Cl-、HCO3-、NO3- |
| D、Ca2+、Na+、Fe3+、CO32- |
已知某反应的焓变小于零,则下列叙述正确的是( )
| A、该反应一定是放热反应 |
| B、该反应一定是吸热反应 |
| C、该反应中反应物的总能量一定小于产物的总能量 |
| D、该反应需要加热才能发生 |
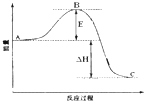 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.下列说法正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.下列说法正确的是( )| A、图中A、C分别表示反应物总能量和生成物总能量 | ||
| B、加入催化剂,图中E和△H都减小 | ||
| C、图中△H=-99kJ?mol-1 | ||
D、SO3(g)?
|
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4 L CHCl3中含有的氯原子数目为3NA |
| B、7 g CnH2n中含有的氢原子数目为NA |
| C、18 g D2O中含有的质子数目为10 NA |
| D、1 L 0.5 mol?L-1Na2CO3溶液中含有的CO32-数目为0.5 NA |
 酸碱中和滴定常用于测定酸碱溶液的浓度.
酸碱中和滴定常用于测定酸碱溶液的浓度.