题目内容
完成下列反应的化学方程式或要求:
(1)写出电解饱和食盐水制氯气的化学反应方程式: .
(2)写出电解熔融氯化镁制取金属镁的化学反应方程式: .
(3)用双线桥标出下述反应中电子转移的方向和数目C+4HNO3(浓)
CO2↑+4NO2↑+2H2O .
(1)写出电解饱和食盐水制氯气的化学反应方程式:
(2)写出电解熔融氯化镁制取金属镁的化学反应方程式:
(3)用双线桥标出下述反应中电子转移的方向和数目C+4HNO3(浓)
| ||
考点:电解原理,氧化还原反应
专题:
分析:(1)电解饱和食盐水生成氢氧化钠、氢气和氯气,据此写出化学方程式;
(2)电解熔融状态的氯化镁可以得到镁和氯气,根据反应物和生成物以及反应条件写出化学方程式;
(3)该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,所以碳作还原剂、硝酸作氧化剂,转移电子数是4.
(2)电解熔融状态的氯化镁可以得到镁和氯气,根据反应物和生成物以及反应条件写出化学方程式;
(3)该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,所以碳作还原剂、硝酸作氧化剂,转移电子数是4.
解答:
解:(1)电解饱和食盐水的化学方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)无水氯化镁在熔融状态下,通过电解得到金属镁,化学方程式为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑;
(3)该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,得失电子最小公倍数是4,则转移电子数为4,所以电子转移的方向和数目为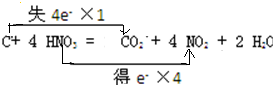 ,故答案为:
,故答案为: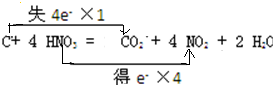 .
.
| ||
| ||
(2)无水氯化镁在熔融状态下,通过电解得到金属镁,化学方程式为:MgCl2(熔融)
| ||
| ||
(3)该反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,得失电子最小公倍数是4,则转移电子数为4,所以电子转移的方向和数目为
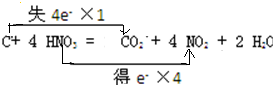 ,故答案为:
,故答案为: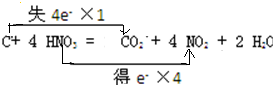 .
.
点评:本题考查学生电解方程式的书写以及氧化还原反应的原理,注意基础知识的积累是关键,难度中等.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
下列说法中正确的是( )
| A、22.4LO2中一定含有6.02×1023个氧分子 |
| B、将80gNaOH固体溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L |
| C、18gH2O在标准状况下的体积是22.4L |
| D、在标准状况时,20mLNH3与60mLO2所含的分子数之比为1:3 |
下列叙述正确的是( )
| A、工业上电解熔融的Al2O3冶炼铝用铁做阳极 |
| B、用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 |
| C、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成2 molNaOH |
| D、用惰性电极电解CuSO4溶液一段时间后,加入CuO固体可以使CuSO4溶液恢复原来浓度 |
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、T、Q的氢化物常态下均为无色气体 |
| B、L、M的单质与稀盐酸反应速率:M>L |
| C、R的氧化物对应的水化物可能具有两性 |
| D、L、Q形成的简单离子核外电子数相等 |
实验室制取氧气的反应为2KClO3
2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)( )
| ||
| △ |
| A、溶解、过滤、蒸发、洗涤 |
| B、溶解、过滤、洗涤、干燥 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、洗涤、过滤、加热 |
 在图所示的物质相互转化关系中,A是一种固体单质,E是一种白色的溶解度很小的物质.据此填空
在图所示的物质相互转化关系中,A是一种固体单质,E是一种白色的溶解度很小的物质.据此填空

 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成