题目内容
CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
①混合气体的平均相对分子质量 .
②列式并计算平衡常数K= .
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是 .
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正 v逆(填“>”、“<”“=”).
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
②列式并计算平衡常数K=
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正
考点:化学平衡的计算
专题:化学平衡专题
分析:①依据混合气体的平均相对分子质量=
计算得到;
②平衡常数是利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积计算得到;
③依据极值转化和反应是可逆反应不能进行彻底分析判断取值范围;
④依据浓度商和平衡常数比较判断反应进行的方向.
| 总重量 |
| 总物质的量 |
②平衡常数是利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积计算得到;
③依据极值转化和反应是可逆反应不能进行彻底分析判断取值范围;
④依据浓度商和平衡常数比较判断反应进行的方向.
解答:
解:①图表数据分析可知,n(CO)=2L×0.9mol/L=1.8mol;n(H2)=2L×1.0mol/L=2mol;n(CH3OH)=2L×0.6mol/L=1.2mol;
混合气体的平均摩尔质量=
=
=18.56g/mol;
所以混合气体的平均相对分子质量18.56,
故答案为:18.56;
②CO(g)+2H2(g)?CH3OH(g),由图表中物质平衡浓度可知,K=
=0.67 L2?moL-2;
故答案为:
=0.67 L2?moL-2;
③CO(g)+2H2(g)?CH3OH(g),若将容器体积压缩为1L,个物质浓度应变为原来的2倍,但压强增大,平衡向气体体积减小的方向进行,反应正向进行,平衡浓度小于2mol/L,所以氢气的平衡浓度应1 mol?L-1<c(H2)<2 mol?L-1;
故答案为:1 mol?L-1<c(H2)<2 mol?L-1;
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,则 各物质浓度为
CO(g)+2H2(g)?CH3OH(g),
0.9+0.6=1.5 1.0 0.6+0.4=1
Q=
=0.67=K
说明费用达到的平衡和原来的平衡状态相同,则V正=V逆;
故答案为:=.
混合气体的平均摩尔质量=
| 总重量 |
| 总物质的量 |
| 1.8mol×28g/mol+2mol×28g/mol+1.2mol×2g/mol |
| 1.8mol+2mol+1.2mol |
所以混合气体的平均相对分子质量18.56,
故答案为:18.56;
②CO(g)+2H2(g)?CH3OH(g),由图表中物质平衡浓度可知,K=
| 0.6 |
| 0.9×1.02 |
故答案为:
| 0.6 |
| 0.9×1.02 |
③CO(g)+2H2(g)?CH3OH(g),若将容器体积压缩为1L,个物质浓度应变为原来的2倍,但压强增大,平衡向气体体积减小的方向进行,反应正向进行,平衡浓度小于2mol/L,所以氢气的平衡浓度应1 mol?L-1<c(H2)<2 mol?L-1;
故答案为:1 mol?L-1<c(H2)<2 mol?L-1;
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,则 各物质浓度为
CO(g)+2H2(g)?CH3OH(g),
0.9+0.6=1.5 1.0 0.6+0.4=1
Q=
| 1 |
| 1.5×12 |
说明费用达到的平衡和原来的平衡状态相同,则V正=V逆;
故答案为:=.
点评:本题考查了平衡状态的分析判断,平衡常数的计算应用和分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
互为同分异构体的一组物质是( )
| A、金刚石和石墨 |
| B、168O和188O |
| C、CH2=CH2和CH3CH3 |
D、CH3CH2 CH2CH3和 |
下列离子方程式正确的是( )
| A、锌与稀硫酸反应:Zn+2H+=Zn2++H2↑ |
| B、碳酸钙与稀硝酸反应:CO32-+2H+=H2O+CO2↑ |
| C、氢氧化铝与盐酸反应:H++OH-=H2O |
| D、氯化镁溶液与氢氧化钠溶液反应:Mg2++OH-=Mg(OH)2↓ |

 b.
b. c.
c.
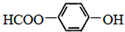 b.
b. c.
c.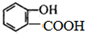
 的名称为
的名称为 核磁共振氢谱有
核磁共振氢谱有 .
. (1)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ.则理论上1mol N2生成NH3
(1)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ.则理论上1mol N2生成NH3