题目内容
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。已知几种化学的键能数据如下表所示:
2ClNO(g)。已知几种化学的键能数据如下表所示:

当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为____kJ.
(2)在一个恒容密闭容器中充入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
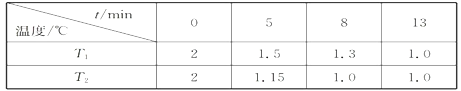
①T1________T2(填“>“”<”或”=”)。
②温度为T2℃时,在相同容器中,充入4molNO(g)和2mo1Cl2(g),则NO的平衡转化率___________50%(填“大于”、“等于”或“小于”)
③温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示
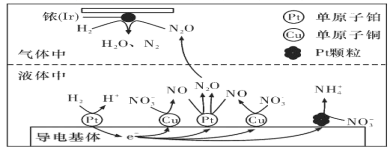
①Ir表面发生反应的方程式为_________________________________________________。
②若导电基体上的Pt颗粒增多,造成的后果是___________________________________。
II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示
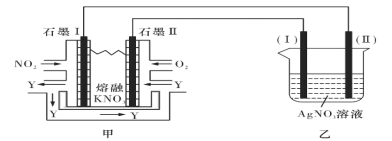
请回答下列问题:
(4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II负极发生的电极反应式为____________________________________________。
②若用10A的电流电解60min,已知该电解池的电解效率为80.4%,则乙中阴极得到____g质量的Ag。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C/mol)
【答案】222.0 < 大于 ![]() H2+N2O = N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体 O2+4e-+2N2O5=4NO3- 32.4
H2+N2O = N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体 O2+4e-+2N2O5=4NO3- 32.4
【解析】
(1)2NO(g)+Cl2(g)2ClNO(g),反应的焓变△H=反应物总键能-生成物总键能,据此计算;
(2)①温度越高,反应速率越大,达到平衡状态所需要的时间短;
②在相同容器中,充入4mol NO和2mol Cl2,相当于增加一倍反应物浓度,容器中压强增大,反应向正反应方向进行;据此分析;
③分压=总压×物质的量分数,则Kp=![]() ;
;
(3)①由原理的示意图可知,Ir的表面氢气和N2O发生反应生成N2和H2O;
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根。
(4)①甲池工作时,NO2转变成N2O5,说明氮元素的化合价升高,石墨Ⅰ为负极,电极反应式为NO2+NO3--e-=N2O5,石墨Ⅱ为正极O2+2N2O5+4e-═4NO3-;
②先计算电子的物质的量,求出理论可得到Ag,再根据电解效率求出实际所得。
(1)2NO(g)+Cl2(g)2ClNO(g),1mol Cl2参与反应发生焓变△H=243KJ/mol+2×630KJ/mol-2×(200KJ/mol+607KJ/mol)=-111kJ/mol,此时转移2mol电子,则有4mol电子转移时,热量变化为222.0kJ,
故答案为:222.0;
(2)①温度越高,反应速率越大,单位时间内消耗NO的量越多,所以T1<T2,
故答案为:<;
②在一个恒容密闭容器中充入2 mol NO(g)和1molCl2(g)发生(2)中反应,达到平衡状态,NO转化率=(2mol-1mol)/2mol×100%=50%,在相同容器中,充入4mol NO和2mol Cl2,相当于增加一倍反应物浓度,容器中压强增大,反应向正反应方向进行,
故答案为:大于;
③起始物质的量为3mol,压强为p0,反应后各物质变化为:n(NO)=1mol,n(Cl2)=0.5,n(ClNO)=1mol,反应后总物质的量为2.5mol,压强为2.5/3P0=5/6P0,则 ,故答案为:
,故答案为:![]() ;
;
(3)①由原理的示意图可知,Ir的表面发生反应:H2+N2O = N2+H2O,
故答案为:H2+N2O = N2+H2O
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根,不利于降低溶液中的含氮量,
故答案为:若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体;
(4)①甲池工作时,NO2转变成N2O5,说明氮元素的化合价升高,石墨Ⅰ为负极,电极反应式为NO2+NO3--e-=N2O5,石墨Ⅱ为正极,电极反应:O2+2N2O5+4e-═4NO3-,
故答案为:O2+2N2O5+4e-═4NO3-;
②用10A的电流电解60min,则电子的物质的量为(10×60×60)/96500mol=0.373mol,理论可得到0.373molAg,电池效率为80.4%,所以实际得到的Ag为0.373mol×80.4%=32.4g,
故答案为:32.4。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
选项 | A | B | C | D |
图像 |
|
|
|
|
反应 | aX(g)+bY(g)cZ(g) | L(s)+aG(g)bR(g) | aA+bBcC | A+2B2C+3D |
操作或条件 | 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体,D为固体或液体 |
A.AB.BC.CD.D