题目内容
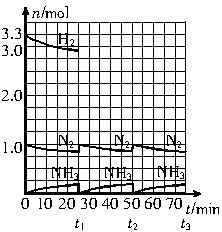
在实验室中进行合成氨工业的模拟实验,当反应进行一段时间,并建立相应的平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程,在
请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)=___________。在25 min时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_________。
(2)在t1时,曲线发生变化的原因是_______________、_______________。请计算氢气在变化后t1起点时的坐标(___________,___________)以及在t2平衡时的坐标(___________,___________)。
(3)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=___________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)=___________。
(4)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2)∶n(H2)=_________。
(1)1∶3.3 0.012 mol·L-1·min-1
(2)分离氨,补充氮气和氢气 (25,3.33) (50,3.03)
(3)3∶11 11∶10
(4)1∶3
解析:(1)v(H2)=![]() =0.012 mol·L-1·min-1
=0.012 mol·L-1·min-1
(2)由图象知,t1时分离出了氨,并补充了氮气和氢气。
N2 + 3H2![]() 2NH3
2NH3
开始 1.0 3.3
反应 0.1 0.3 0.2
平衡 0.9 3.0 0.2
t1时补充N2 0.1 mol,则需补充H2 0.33 mol,所以t1时H2坐标为(25,3.33),t2平衡时H2的坐标为(50,3.03)。
(3)H2每次循环增加0.03 mol,十次增加0.3 mol,所以十次循环后N2为1.0 mol,H2为3.6 mol,当t11达到平衡时,n(N2)∶n(H2)=0.9∶3.3=3∶11。
设循环了n次,α(N2)=![]() ,α(H2)=
,α(H2)=![]() ,所以α(N2)∶α(H2)=11∶10。
,所以α(N2)∶α(H2)=11∶10。

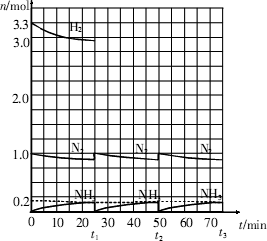
 2NH3(g);ΔH<0
2NH3(g);ΔH<0

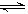 2NH3(g);ΔH<0。请根据图示回答下列问题:
2NH3(g);ΔH<0。请根据图示回答下列问题: