题目内容
16.碱式次氯酸镁微溶于水,不吸湿,相对稳定,是一种有开发价值的无机抗菌剂.某研发小组通过下列流程制备碱式次氯酸镁:
(1)从上述流程中可以判断,滤液中可回收的主要物质是NaCl.
(2)NaClO溶液用Cl2与NaOH溶液反应获得,写出该反应的化学方程式.2NaOH+Cl2=NaCl+NaClO+H2O
(3)写出制取碱式次氯酸镁的化学方程式.2MgCl2+NaClO+3NaOH+H2O═Mg2ClO(OH)3•H2O+4NaCl
(4)该反应属于非氧化还原反应(填“氧化还原反应”或“非氧化还原反应”);原因是无元素化合升降.
分析 向MgCl2溶液中加入NaClO溶液,然后向溶液中加入NaOH溶液并调节溶液的pH,碱式次氯酸镁[Mg2ClO(OH)3•H2O]微溶于水,所以得到碱式次氯酸镁[Mg2ClO(OH)3•H2O]沉淀和NaCl,过滤得到碱式次氯酸镁[Mg2ClO(OH)3•H2O]固体,滤液中成分是NaCl,然后将沉淀洗涤、干燥得到碱式次氯酸镁[Mg2ClO(OH)3•H2O],可据此分析作答:
(1)滤液中的主要物质是NaCl;
(2)Cl2与NaOH溶液反应生成NaCl、NaClO和H2O;
(3)MgCl2和NaClO溶液中加入NaOH溶液并调节溶液的pH=10,可得到碱式次氯酸镁[Mg2ClO(OH)3•H2O],结合质量守恒定律可写出此反应的化学方程式;
(4)制备碱性次氯酸镁的反应中没有元素化合价的变化.
解答 解:向MgCl2溶液中加入NaClO溶液,然后向溶液中加入NaOH溶液并调节溶液的pH,碱式次氯酸镁[Mg2ClO(OH)3•H2O]微溶于水,所以得到碱式次氯酸镁[Mg2ClO(OH)3•H2O]沉淀和NaCl,过滤得到碱式次氯酸镁[Mg2ClO(OH)3•H2O]固体,滤液中成分是NaCl,然后将沉淀洗涤、干燥得到碱式次氯酸镁[Mg2ClO(OH)3•H2O],
(1)滤液中的主要物质是NaCl,所以滤液中可回收的主要物质是NaCl,故答案为:NaCl;
(2)Cl2与NaOH溶液反应生成NaCl、NaClO和H2O,反应方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
(3)MgCl2和NaClO混合溶液中加入NaOH得到碱式次氯酸镁,发生反应的化学方程式为2MgCl2+NaClO+3NaOH+H2O═Mg2ClO(OH)3•H2O+4NaCl,故答案为:2MgCl2+NaClO+3NaOH+H2O═Mg2ClO(OH)3•H2O+4NaCl;
(4)(3)中反应前后无元素化合价的变化,属非氧化还原反应,故答案为:非氧化还原反应;无元素化合升降.
点评 本题考查物质分离和提纯,侧重考查学生分析、计算、信息利用能力,明确工艺流程原理是解本题关键,知道每一步发生的反应及其操作,熟练掌握元素化合物知识是解题关键,题目难度中等.

| A. | CuCl2+H2S═CuS↓+2HCl | B. | 2HCl+Na2S═2NaCl+H2S | ||
| C. | Cl2+H2S═2HCl+S | D. | 3Cl2+6FeSO4═2Fe2(SO4)3+2FeCl3 |
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
(1)第②步中所加CaCO3还发生了其它反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
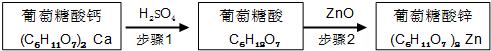
步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH
(3)A、B、C、G的离子按离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅢA族.
(6)有两种化合物M和N都由AFIJ四种元素组成.若M与N在水溶液中能发生离子反应,则该反应的离子方程式为HSO3-+H+=H2O+SO2↑.
(7)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.



 实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:
实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:
 (乙酸酐)制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑等副反应.
(乙酸酐)制备过程中还有CH3COOH+AlCl3→CH3COOAlCl2+HCl↑等副反应.