题目内容
臭氧能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图 ,实线表示σ键,另外中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部)--三个O原子均等地享有这4个电子.根据等电子体原理,下列分子中与O3分子的结构最相似的是( )
,实线表示σ键,另外中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部)--三个O原子均等地享有这4个电子.根据等电子体原理,下列分子中与O3分子的结构最相似的是( )
 ,实线表示σ键,另外中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部)--三个O原子均等地享有这4个电子.根据等电子体原理,下列分子中与O3分子的结构最相似的是( )
,实线表示σ键,另外中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部)--三个O原子均等地享有这4个电子.根据等电子体原理,下列分子中与O3分子的结构最相似的是( )| A、SO2 |
| B、CO2 |
| C、H2O |
| D、BeCl2 |
考点:判断简单分子或离子的构型,“等电子原理”的应用
专题:化学键与晶体结构
分析:根据分子中中心原子的价层电子对数判断分子的空间构型,然后判断.
解答:
解:已知O3分子的结构如图 ,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子称折线形,在三个氧原子之间还存在着一个垂直于分子平面的大π键,这个离域的π键是由中心的氧原子提供两个p电子、另外两个配位氧原子各提供一个p电子形成的,
,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子称折线形,在三个氧原子之间还存在着一个垂直于分子平面的大π键,这个离域的π键是由中心的氧原子提供两个p电子、另外两个配位氧原子各提供一个p电子形成的,
A、SO2分子呈“V”字形结构,其成键方式与O3类似,S原子sp2杂化,S原子和两侧的氧原子除以σ键结合以外,还形成一个三中心四电子的大π键,故A正确;
B、CO2为含有2对σ键电子对,为sp杂化,空间结构为直线形,故B错误;
C、H2O中O含有4对价层电子对,为sp3杂化,含有2对孤电子对,为“V”字形结构,但是分子中没有大π键,故C错误;
D、BeCl2含有3对价层电子对,为sp2杂化,没有孤电子对,为平面三角形,故D错误;
故选A.
 ,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子称折线形,在三个氧原子之间还存在着一个垂直于分子平面的大π键,这个离域的π键是由中心的氧原子提供两个p电子、另外两个配位氧原子各提供一个p电子形成的,
,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,使O3分子称折线形,在三个氧原子之间还存在着一个垂直于分子平面的大π键,这个离域的π键是由中心的氧原子提供两个p电子、另外两个配位氧原子各提供一个p电子形成的,A、SO2分子呈“V”字形结构,其成键方式与O3类似,S原子sp2杂化,S原子和两侧的氧原子除以σ键结合以外,还形成一个三中心四电子的大π键,故A正确;
B、CO2为含有2对σ键电子对,为sp杂化,空间结构为直线形,故B错误;
C、H2O中O含有4对价层电子对,为sp3杂化,含有2对孤电子对,为“V”字形结构,但是分子中没有大π键,故C错误;
D、BeCl2含有3对价层电子对,为sp2杂化,没有孤电子对,为平面三角形,故D错误;
故选A.
点评:本题考查了分子的空间构型的判断,注意根据分子的中心原子的价层电子对数判断,题目难度中等.

练习册系列答案
相关题目
在同温同压下,下列各组热化学方程式中 Q2>Q1的是( )
| A、2H2(g)+02(g)=2H20(g);△H1=-Q1 2H2(g)+02(g)=2H20(1);△H2=-Q2 | ||||
| B、S(g)+O2(g)=S02(g);△H1=-Q1 S(s)+02(g)=S02(g);△H2=-Q2 | ||||
C、C(s)+
C(s)+02(g)=C02(g);△H2=-Q2 | ||||
D、H2(g)+Cl2(g)=2HCl(g);△H1=-Q1
|
对于常温下pH为1的H2SO4溶液,下列叙述正确的是( )
| A、该溶液1mL稀释至100mL后,pH等于2 |
| B、向该溶液中加入等体积、pH为13的NaOH溶液恰好完全中和 |
| C、该溶液中H2SO4电离出的c(H+)与水电离出的c(H+)之比为10-12 |
| D、1L该溶液中含有H2SO4分子的物质的量为0.05mol |
下列有机物的名称一定错误的是( )
| A、2一甲基一1一丁烯 |
| B、2,2一 二甲基丙烷 |
| C、5,5一二甲基一3一己烯 |
| D、4一甲基一2一戊炔 |
实验室区别下列物质选用的试剂(括号中的为试剂,必要时可加热)不正确的是( )
| A、苯和己烯 (溴水) |
| B、矿物油和植物油 (NaOH溶液) |
| C、乙醛和乙酸 (银氨溶液) |
| D、硝基苯和CCl4(水) |
下列说法正确的是(设阿伏加德罗常数的数值为6.02×1023)( )
| A、在标准状况下,22.4L苯所含分子数目为6.02×1023 |
| B、1mol/LK2SO4溶液所含K+数目为6.02×1023 |
| C、2g氢气所含的原子数为NA |
| D、在常温常压下,16gO2和O3的混合气体所含原子数目为6.02×1023 |
下列描述的一定是金属元素的是( )
| A、能与酸溶液反应的物质 |
| B、能与碱溶液反应的物质 |
| C、原子核内有13个质子的元素 |
| D、原子的最外电子层只有1个电子的元素 |
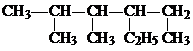 的名称是
的名称是 化合物A中含氧官能团的名称
化合物A中含氧官能团的名称 用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )