题目内容
 用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是
用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是
- A.将水准管上提,液面高于量气管且不下降,说明装置不漏气
- B.镁表面的氧化物没有完全去除,可导致测定结果偏高
- C.读取气体体积时水准管的水面高于量气管的水面,可导致测定结果偏高
- D.可用来测定镁的相对原子质量
BC
分析:A.液面高于量气管,产生一段液柱;
B.镁表面的氧化物没有完全去除,生成的气体减少;
C.水准管的水面高于量气管的水面,量气管中压力增大,气体体积变小;
D.由n=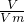 及Mg~H2可知Mg的物质的量.
及Mg~H2可知Mg的物质的量.
解答:解:A.由于此装置属于密闭体系,将水准管上提,造成内外压强不等,静置,若液面高于量气管且不下降,说明装置不漏气,故A正确;
B.镁表面的氧化物没有完全去除,生成的气体减少,由Vm= 可知,测得Vm偏小,故B错误;
可知,测得Vm偏小,故B错误;
C.读取气体体积时水准管的水面高于量气管的水面,量气管中压力增大,气体体积变小,由Vm= 可知,测得Vm偏小,故C错误;
可知,测得Vm偏小,故C错误;
D.由Mg+2HCl═MgCl2+H2↑,n=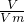 及Mg~H2可知Mg的物质的量,Mg的质量一定,利用M=
及Mg~H2可知Mg的物质的量,Mg的质量一定,利用M=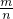 计算得到摩尔质量,摩尔质量与相对分子质量数值相等,故D正确;
计算得到摩尔质量,摩尔质量与相对分子质量数值相等,故D正确;
故选BC.
点评:本题考查了仪器的创新应用来测定气体摩尔体积,注意量气装置中所用液体一般是水,气体在水中溶解度很小,明确液柱法检查装置的气密性,题目难度中等.
分析:A.液面高于量气管,产生一段液柱;
B.镁表面的氧化物没有完全去除,生成的气体减少;
C.水准管的水面高于量气管的水面,量气管中压力增大,气体体积变小;
D.由n=
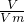 及Mg~H2可知Mg的物质的量.
及Mg~H2可知Mg的物质的量.解答:解:A.由于此装置属于密闭体系,将水准管上提,造成内外压强不等,静置,若液面高于量气管且不下降,说明装置不漏气,故A正确;
B.镁表面的氧化物没有完全去除,生成的气体减少,由Vm=
 可知,测得Vm偏小,故B错误;
可知,测得Vm偏小,故B错误;C.读取气体体积时水准管的水面高于量气管的水面,量气管中压力增大,气体体积变小,由Vm=
 可知,测得Vm偏小,故C错误;
可知,测得Vm偏小,故C错误;D.由Mg+2HCl═MgCl2+H2↑,n=
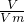 及Mg~H2可知Mg的物质的量,Mg的质量一定,利用M=
及Mg~H2可知Mg的物质的量,Mg的质量一定,利用M=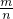 计算得到摩尔质量,摩尔质量与相对分子质量数值相等,故D正确;
计算得到摩尔质量,摩尔质量与相对分子质量数值相等,故D正确;故选BC.
点评:本题考查了仪器的创新应用来测定气体摩尔体积,注意量气装置中所用液体一般是水,气体在水中溶解度很小,明确液柱法检查装置的气密性,题目难度中等.

练习册系列答案
相关题目
 某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
[实验一]取样品0.100g,用如图所示实验装置进行测定.(夹持装置省略)
(1)检查装置A气密性的方法是______.
(2)若在实验过程中共产生气体11.20mL(已折算成标准状况),则样品中Na2O2的纯度为______.
[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到______.
(4)取上述所配溶液各25.00mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
[实验分析]实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小.经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因.查阅资料发现:Na2O2与水反应产生的H2O2未完全分解.
①写出Na2O2与水生成H2O2的化学方程式______.
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:______.
某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
[实验一]取样品0.100g,用如图所示实验装置进行测定.(夹持装置省略)
(1)检查装置A气密性的方法是______.
(2)若在实验过程中共产生气体11.20mL(已折算成标准状况),则样品中Na2O2的纯度为______.
[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到______.
(4)取上述所配溶液各25.00mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
由表中数据可知,标准盐酸体积的平均值为______mL.若滴定前用上述所配溶液润洗锥形瓶,对实验测定结果产生的影响是______(填“偏高”、“偏低”或“无影响”).
[实验分析]实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小.经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因.查阅资料发现:Na2O2与水反应产生的H2O2未完全分解.
①写出Na2O2与水生成H2O2的化学方程式______.
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:______.

[实验一]取样品0.100g,用如图所示实验装置进行测定.(夹持装置省略)
(1)检查装置A气密性的方法是______.
(2)若在实验过程中共产生气体11.20mL(已折算成标准状况),则样品中Na2O2的纯度为______.
[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到______.
(4)取上述所配溶液各25.00mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
[实验分析]实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小.经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因.查阅资料发现:Na2O2与水反应产生的H2O2未完全分解.
①写出Na2O2与水生成H2O2的化学方程式______.
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:______.

 为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.
为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低. (2011?静安区模拟)关于如图所示实验装置的叙述错误的是( )
(2011?静安区模拟)关于如图所示实验装置的叙述错误的是( )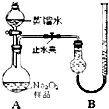 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.