题目内容
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料,难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式是_________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验:
①第一支试管中加入几滴KSCN溶液,溶液不变红;
②第二支试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入几滴酸性KMnO4溶液,溶液紫红色褪去。
上述实验能证明水合草酸亚铁中存在Fe2+的是_________(填编号)。
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
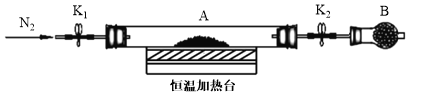
验步骤如下:a.打开K1和K2,缓缓通入N2;b.加热装置A一段时间;c.停止加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述步骤,直至A恒重,记为m3 g。
①步骤b至步骤c继续通入N2的目的是 ________________。
②根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=______(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
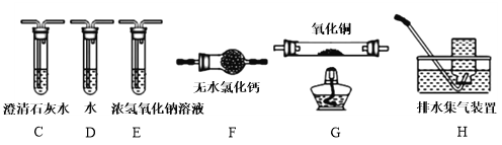
①写出草酸亚铁受热分解的化学方程式____________。
②实验装置中,依次连接的合理顺序为A、____________。
【答案】 FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4 ② 将装置A中的水蒸气带走;同时防止FeC2O4冷却时被氧化 ![]() 3FeC2O4 = Fe3O4 + 4CO↑+ 2CO2↑ C E (C) F G C H
3FeC2O4 = Fe3O4 + 4CO↑+ 2CO2↑ C E (C) F G C H
【解析】(1)硫酸亚铁溶液和草酸反应的化学方程式是FeSO4+H2C2O4+xH2O=FeC2O4·xH2O↓+H2SO4;(2)①向试管中加入几滴KSCN溶液,溶液不变红,不能说明肯定存在Fe2+;向试管中加入几滴K3[Fe(CN)6]溶液,生成蓝色沉淀,说明肯定存在Fe2+;草酸根离子、Fe2+均能与紫红色酸性KMnO4溶液反应,不能说明肯定存在Fe2+;故答案选②。(3)①在无氧环境中进行反应,防止FeC2O4冷却时被氧化,同时将装置A中的水蒸气转移出A装置;②m(H2O)=(m3-m1)g,m(FeC2O4)= (m2-m3)g,
FeC2O4·xH2O= FeC2O4 + xH2O
144 18x中
(m2-m3)g (m3-m1)g 得到x=![]()
(4)①由于分解后有磁性的黑色化合物生成,该化合物为Fe3O4,铁元素化合价有变化,说明分解过程中发生了氧化还原反应,化学方程式为:3FeC2O4 = Fe3O4 + 4CO↑+ 2CO2↑;②生成的气体先通过澄清石灰水来证明二氧化碳的存在,再通过浓的氢氧化钠吸收二氧化碳,再通过澄清石灰水来证明二氧化碳已吸收完全,气体经干燥灼热的氧化铜,将产生后气体澄清石灰水来证明又生成了二氧化碳,最后进行尾气处理;依次连接的合理顺序为A、C E (C) F G C H。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
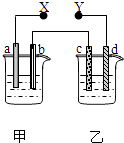
浙江之星学业水平测试系列答案【题目】如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,d极板有无色无臭的气体放出,符合这一情况的是( )
选项 | a 极板 | d极板 | X极板 | 乙中溶液 |
A | 锌 | 铜 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.A
B.B
C.C
D.D