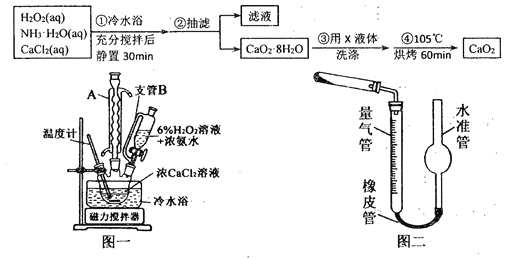
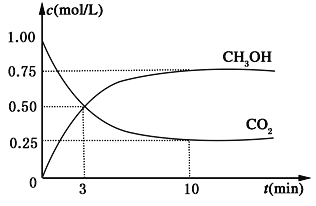
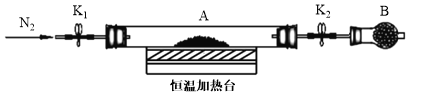
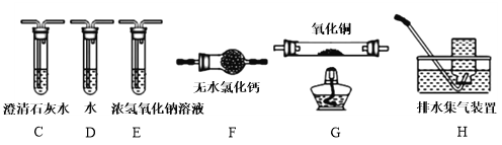
题目内容
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是
2Z(g)+W(s) ΔH<0,下列叙述正确的是
A. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
B. 达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
C. 达到平衡时,反应速率v正(X)=2v逆(Z)
D. 平衡常数K值越大,X的转化率越大
【答案】D
【解析】A、达到平衡后,升高温度有利于该反应平衡向逆反应方向移动,但是增大压强化学平衡不会移动,选项A错误;B、达到平衡后,降低温度,正逆向反应速率均会减小,但是化学平衡正向移动,所以正向反应速率减小的倍数小于逆向反应速率减小的倍数,选项B错误;C、达到平衡时,反应速率2v正(X)=v逆(Z),选项C错误;D、平衡常数K值越大,表示化学反应进行的程度越大,则反应物X的转化率越大,选项D正确。答案选D。

练习册系列答案
相关题目
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是 ( )
A | B | C | D | |
反应 装置或 图像 |
|
|
|
|
实验现 象或图 像信息 | 温度计的 水银柱不 断上升 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 反应开始 后,针筒活 塞向右移动 |
A. A B. B C. C D. D