题目内容
(选做题)【化学——物质结构与性质】下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
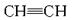
(1)请写出下图中d单质对应元素原子的电子排布式__________________。
(2)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________个σ键和_________个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到配合物的化学式为__________________,其中X与Ag+之间以__________________键结合。
(4)下图是上述六种元素中的一种元素形成的含氧酸的结构;请简要说明该物质易溶于水的原因___________________________。
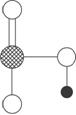
(1)1s22s22p63s23p63d104s1
(2)3 2
(3)三角锥形[Ag(NH3)2]OH 配位
(4)HNO3是极性分子,易溶于极性的水中;HNO3分子易与水分子之间形成氢键
解析:a—f依次是H2、N2、Na、Cu、Si、C。
(1)Cu的电子排布式1s22s22p63s23p63d104s1
(2)C∶H=1∶1,M=13×2=26,则该分子为![]() ,含有3个σ键和2个π键
,含有3个σ键和2个π键
(3)NH3的空间构型为三角锥形;配合物为银氨溶液,化学式为[Ag(NH3)2]OH,NH3与Ag+以配位键结合。
(4)该物质为HNO3,HNO3是极性分子,易溶于极性溶剂水;HNO3分子与H2O分子之间形成氢键。

练习册系列答案
相关题目
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。