题目内容
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)X、Y的元素符号依次为
(2)YZ2分子式是
(3)Q的元素符号是
(4)E的氢化物溶液中存在的氢键有四种,可分别表示为:F-H…F、F-H…O、
(1)X、Y的元素符号依次为
S
S
、O
O
;Y、Z、E第一电离能由大到小的顺序为(用元素符号回答)F>O>C
F>O>C
.(2)YZ2分子式是
CO2
CO2
空间结构是直线型
直线型
,它在水中的溶解度较小,理由是H2O是极性分子,相似相溶,而CO2是非极性分子
H2O是极性分子,相似相溶,而CO2是非极性分子
;(3)Q的元素符号是
Cr
Cr
,它属于第四
四
周期,它的核外电子排布式为1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
,在形成化合物时它的最高化合价为+6
+6
;(4)E的氢化物溶液中存在的氢键有四种,可分别表示为:F-H…F、F-H…O、
H-O-H…F
H-O-H…F
和H-O-H…O
H-O-H…O
.分析:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,结合元素对应单质、化合物的结构和性质解答该题.
解答:解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,则
(1)由以上分析可知,X为S,Y为C;同周期自左而右元素第一电离能呈增大趋势,故第一电离能F>O>C,
故答案为:S,C;F>O>C;
(2)Y为C元素,Z为O元素,YZ2分子式是CO2,CO2中C和O形成2个δ键,没有孤电子对,为直线形;
CO2是非极性分子,H2O是极性分子,相似相溶,故CO2在水中的溶解度较小,
故答案为:CO2;直线形;H2O是极性分子,相似相溶,而CO2是非极性分子;
(3)Q为Cr,原子序数为24,位于周期表第四周期ⅥB族,核外电子排布式为1s22s22p63s23p63d54s1,价电子层电子排布式为3d54s1,最高化合价为+6价,
故答案为:Cr;四;1s22s22p63s23p63d54s1;+6;
(4)HF的水溶液中,O、F的电负性较大,HF与HF之间存在氢键,水与HF中的H原子之间存在氢键,HF与水中的H原子之间,水分子之间存在氢键,可表示为F-H…F、F-H…O、H-O-H…F、H-O-H…O,
故答案为:H-O-H…F、H-O-H…O.
(1)由以上分析可知,X为S,Y为C;同周期自左而右元素第一电离能呈增大趋势,故第一电离能F>O>C,
故答案为:S,C;F>O>C;
(2)Y为C元素,Z为O元素,YZ2分子式是CO2,CO2中C和O形成2个δ键,没有孤电子对,为直线形;
CO2是非极性分子,H2O是极性分子,相似相溶,故CO2在水中的溶解度较小,
故答案为:CO2;直线形;H2O是极性分子,相似相溶,而CO2是非极性分子;
(3)Q为Cr,原子序数为24,位于周期表第四周期ⅥB族,核外电子排布式为1s22s22p63s23p63d54s1,价电子层电子排布式为3d54s1,最高化合价为+6价,
故答案为:Cr;四;1s22s22p63s23p63d54s1;+6;
(4)HF的水溶液中,O、F的电负性较大,HF与HF之间存在氢键,水与HF中的H原子之间存在氢键,HF与水中的H原子之间,水分子之间存在氢键,可表示为F-H…F、F-H…O、H-O-H…F、H-O-H…O,
故答案为:H-O-H…F、H-O-H…O.
点评:本题考查原子结构与元素的性质,题目难度中等,本题注意把握原子核外电子排布,推断元素的种类是关键,注意把握理解分子极性与溶解性关系,氢键的表示.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
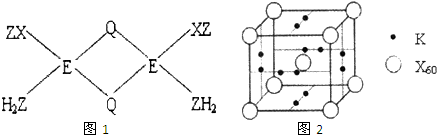 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题: