题目内容
在FeCl3,CuCl2,FeCl2的混合溶液中,Fe3+,Cu2+和Fe2+的物质的量之比为3:2:1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1:2:4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为( )
| A、2:1 | B、1:2 |
| C、1:3 | D、1:4 |
考点:离子方程式的有关计算
专题:计算题
分析:因氧化性:Fe3+>Cu2+>Fe2+,加入适量的铁粉,使溶液中Fe3+、Cu2+和Fe2+物质的量之比变为1:2:4,说明Fe3+有剩余,则Cu2+没有参加反应,加入Fe粉仅与Fe3+反应,假设原溶液中含有Fe3+、Cu2+、Fe2+的物质的量分别为3mol、2mol、1mol,根据反应后溶液中离子比例关系计算Fe3+离子物质的量变化,结合方程式计算.
解答:
解:因氧化性:Fe3+>Cu2+>Fe2+,加入适量的铁粉,使溶液中Fe3+、Cu2+和Fe2+物质的量之比变为1:2:4,说明Fe3+有剩余,
则Cu2+没有参加反应,加入Fe粉仅与Fe3+反应,
设原溶液中含有Fe3+、Cu2+、Fe2+的物质的量分别为3mol、2mol、1mol,反应后Fe3+、Cu2+和Fe2+物质的量之比变为1:2:4,则反应后Fe3+、Cu2+、Fe2+的物质的量分别为1mol、2mol、4mol,
故反应的Fe3+的物质的量为3mol-1mol=2mol,则:
2Fe3++Fe=3Fe2+
2mol 1mol 3mol
故参加反应的Fe的物质的量为1mol,
参加反应的铁粉与原溶液中Fe3+的物质的量之比为1mol:3mol=1:3,
故选C.
则Cu2+没有参加反应,加入Fe粉仅与Fe3+反应,
设原溶液中含有Fe3+、Cu2+、Fe2+的物质的量分别为3mol、2mol、1mol,反应后Fe3+、Cu2+和Fe2+物质的量之比变为1:2:4,则反应后Fe3+、Cu2+、Fe2+的物质的量分别为1mol、2mol、4mol,
故反应的Fe3+的物质的量为3mol-1mol=2mol,则:
2Fe3++Fe=3Fe2+
2mol 1mol 3mol
故参加反应的Fe的物质的量为1mol,
参加反应的铁粉与原溶液中Fe3+的物质的量之比为1mol:3mol=1:3,
故选C.
点评:本题考查混合物的计算,关键是正确判断离子的氧化性强弱,判断反应的程度,再结合反应的离子方程式计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将15.6g Na2O2与5.4g Al同时放入一定量的水中,充分溶解后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液体积不变,则下列说法正确的是( )
| A、最终得到的溶液中:C(Na+)=C(Cl-)+C(OH-) |
| B、反应过程中得到标准状况下气体的体积为7.84L |
| C、最终得到C(Na+)=1.5mol/L |
| D、最终得到沉淀为Al(OH)3,质量是7.8g |
两种气态烃以任意比例混合,在150℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中不符合此条件的是( )
| A、CH4 C2H4 |
| B、CH4 C3H6 |
| C、C2H4 C3H4 |
| D、CH4 C3H4 |
下列操作不能达到目的是( )
| A、将25g CuSO4?5H2O溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液 |
| B、检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体 |
| C、用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| D、用银氨溶液鉴别葡萄糖和蔗糖 |

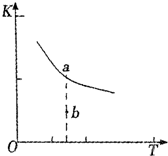 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.