题目内容
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:


①ⅡA族元素的价电子数__________。
②第三周期元素的最高正价__________。
③F-、Na+、Mg2+、Al3+的离子半径__________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①化合物XN的化学式为________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液均呈碱性,组成元素的原子数目之比均为1∶1∶1,B是家庭“84”消毒液的有效成份。则化合物A中的化学键类型为__________,B的化学式为 。
③工业上制取单质M的化学方程式为 。
(1)①b(1分) ②c(1分) ③a(1分)
(2)①HCl(1分) ②离子键、(极性)共价键(2分) NaClO(2分)
③SiO2+2C Si+2CO↑(2分)
Si+2CO↑(2分)
【解析】
试题分析:(1)①因同一主族元素的最外层电子数相等,故选b;②因元素的最高正价=最外层电子数=族序数,同一周期元素的最高化合价逐渐增大,故选c;③核外电子数相同,则核内质子数越多半径越小,所以离子半径为:O2–>F–>Na+>Mg2+>Al3+,故选a。(2)Y元素原子最外层电子数与核外电子总数之比为3:4,则最外层电子数为6,核外电子总数为8,故Y为O;M元素原子的最外层电子数与电子层数之比为4:3,则电子层数为3,最外层电子数为4,故M为Si;N-、Z+、X+离子的半径逐渐减小,且N的原子充数比M大,则N为氯,Z为钠;化合物XN常温下为气体,且X的原子充数最小,则X为氢。①XN为氯化氢,化学式为HCl;②由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液均呈碱性,组成元素的原子数目之比为1:1:1,满足条件的A物质应为NaOH,所以化合物A中既含有离子键又含有共价键,“84”消毒液的有效成份是次氯酸钠,所以B的化学式为NaClO,③工业上用焦炭高温下还原二氧化硅来制备硅,化学方程式为:SiO2+2C Si+2CO↑
Si+2CO↑
考点:考查原子结构与元素的性质、化学键、无机物的推断。

| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
回答下列问题:
(1)该反应在较低温度下能否自发进行?
(2)从323K到353K,氨气的生成量减少的原因
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;
(4)工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
| 4 |
| 7 |
(5)利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为
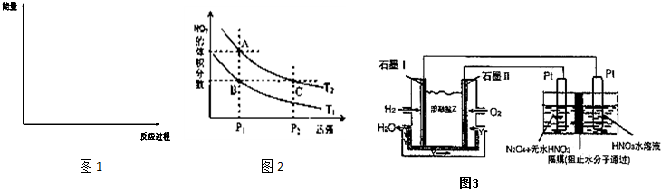
(6)对反应N2O4(g)?2NO2(g),在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
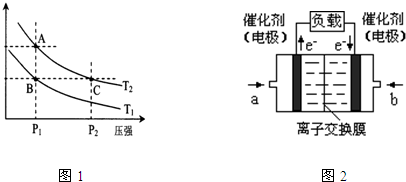
(7)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式
 室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(℃)
室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(℃)



