题目内容
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如图所示.反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为( )

| A.0.20 mol?L-1 | B.0.12 mol?L-1 |
| C.0.10 mol?L-1 | D.0.08 mol?L-1 |

根据图象可知,4min到达平衡,平衡时氨气的浓度为0.1mol/L,保持其它条件不变,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L;
若降低温度平衡向正反应方向方向移动,若氮气、氢气完全转化为氨气,则氨气的浓度为
=0.2mol/L,该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度<0.2mol/L,
若升高温度平衡向逆反应方向移动,氨气完全转化浓度为0,该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度>0,
保持其它条件不变,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L;
故改变温度达平衡后0<c(NH3)<0.2mol/L,且c(NH3)≠0.1mol/L,
故选AC.
若降低温度平衡向正反应方向方向移动,若氮气、氢气完全转化为氨气,则氨气的浓度为
| 0.2mol×2 |
| 2L |
若升高温度平衡向逆反应方向移动,氨气完全转化浓度为0,该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度>0,
保持其它条件不变,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L;
故改变温度达平衡后0<c(NH3)<0.2mol/L,且c(NH3)≠0.1mol/L,
故选AC.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目


 2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:
2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:

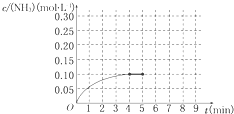 在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示: