题目内容
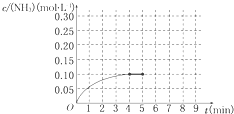 在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:
在一容积为2L的密闭容器内为加入 0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图所示:(1)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
A.0.20mol?L-1 B.0.12mol?L-1
C.0.10mol?L-1 D.0.08mol?L-1
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡
(3)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol?L-1).请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
分析:(1)根据温度对化学平衡的影响分析;
(2)根据压强对化学平衡的影响分析;根据影响化学平衡常数的因素分析;
(3)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图.
(2)根据压强对化学平衡的影响分析;根据影响化学平衡常数的因素分析;
(3)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图.
解答:解:(1)该反应是可逆反应,所以反应物不能完全转化为生成物,所以氨气的浓度不可能为0.20mol/L;Q>0,所以该反应是放热反应,升高温度,平衡向逆反应方向移动,降低温度,平衡向正反应方向移动,所以氨气的浓度不可能为0.10mol/L,故选AC,
故答案为:AC;
(2)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变,
故答案为;向正反应方向;不变;
(3)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L,所以第5分钟末到此平衡时NH3浓度的变化曲线为: ,故答案为:
,故答案为: .
.
故答案为:AC;
(2)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动;化学平衡常数只与温度有关,温度不变,平衡常数不变,
故答案为;向正反应方向;不变;
(3)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L,所以第5分钟末到此平衡时NH3浓度的变化曲线为:
 ,故答案为:
,故答案为: .
.点评:本题考查了化学反应速率的定量表示方法、化学平衡常数、化学平衡的影响因素等知识点,同一化学反应中化学平衡常数只与温度有关,与反应物、生成物的浓度无关.

练习册系列答案
相关题目


 2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:
2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:
