题目内容
19.CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)?CH3OH,下列叙述中能说明上述反应在一定条件下一定达到最大限度的是( )| A. | CO全部转化为乙醇 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | CO和H2以1:2的物质的量之比反应生成甲醇 | |
| D. | 反应体系中甲醇的物质的量浓度不再变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、可逆反应不可能完全转化,故A错误;
B、正逆反应速率相等,都大于0,是动态平衡,故B错误;
C、只要反应发生,CO和H2就以1:2的物质的量之比反应生成甲醇,故C错误;
D、反应体系中甲醇的物质的量浓度不再变化,说明正逆反应速率相等,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
7.用生石灰中和法阻止海水酸化是人们的一种设想.生石灰(CaO)属于( )
| A. | 酸 | B. | 酸性氧化物 | C. | 碱性氧化物 | D. | 盐 |
14.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 mol/L BaCl2溶液中含有的钡离子数为NA | |
| B. | 1 mol镁原子中含有的电子数为2NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 16 g O3中含有的氧原子数为NA |
4.太阳能电池已为人们所熟悉,制造太阳能电池板的核心体材料是( )


| A. | 二氧化硅 | B. | 硅 | C. | 钛合金 | D. | 铝合金 |
11.将下列固体投入适量水中,再滴加酚酞,溶液不会变为红色的是( )
| A. | Na | B. | Na2O | C. | Na2CO3 | D. | NaCl |
8.下列离子方程式书写正确的是( )
| A. | 小苏打溶液呈碱性的原因:HCO3-+H2O?H3O++CO32- | |
| B. | 向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 将含等物质的量的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| D. | 少量A1Cl3溶液滴入过量氨水中:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
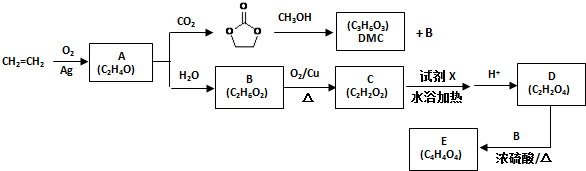
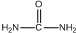 )和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式
)和甲醇在催化剂、加热条件下,发生取代反应生成DMC,请写出该反应的化学反应方程式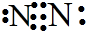 和结构式N≡N.
和结构式N≡N.