题目内容
9.在标准状况下,0.21g某气体的体积为168mL,则该气体的相对分子质量为28,如果此气体是双原子分子,且其原子中质子数与中子数相等,写出该气体的分子式N2,电子式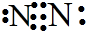 和结构式N≡N.
和结构式N≡N.
分析 根据n=$\frac{V}{{V}_{m}}$计算出其物质的量,再根据M=$\frac{m}{n}$计算出该气体的摩尔质量,从而得出其相对分子质量;该气体是双原子分子,且其原子中质子数与中子数相等,据此确定其名称,然后写出其分子式、电子式及结构式.
解答 解:标况下168mL该气体的物质的量为:n=$\frac{0.168L}{22.4L/mol}$=0.0075mol,该气体的摩尔质量为:M=$\frac{0.21g}{0.0075mol}$=28g/mol,则该气体的相对分子质量为28;
如果此气体是双原子分子,且其原子中质子数与中子数相等,则组成该气体的原子的质子数为:28×$\frac{1}{2}$×$\frac{1}{2}$=7,该元素为N,N原子形成的双原子分子为N2,氮气分子中含有氮氮三键,其电子式为: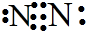 ,用短线代替所有共用电子对即为结构式,则其结构式为:N≡N,
,用短线代替所有共用电子对即为结构式,则其结构式为:N≡N,
故答案为:28;N2;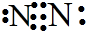 ;N≡N.
;N≡N.
点评 本题考查了阿伏伽德罗定律及其推论的应用,题目难度中等,注意掌握阿伏伽德罗定律及其推论的内容,明确电子式、分子式、结构式的概念及表示方法.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
19.CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)?CH3OH,下列叙述中能说明上述反应在一定条件下一定达到最大限度的是( )
| A. | CO全部转化为乙醇 | |
| B. | 正反应和逆反应的化学反应速率均为零 | |
| C. | CO和H2以1:2的物质的量之比反应生成甲醇 | |
| D. | 反应体系中甲醇的物质的量浓度不再变化 |
20.下列化学用语正确的是( )
| A. | CO2的比例模型: | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | 乙烯的结构简式为:CH2CH2 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH${\;}_{4}^{+}$ | |
| C. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++2OH-═BaSO4↓+H2O | |
| D. | 向氨水通入足量SO2:SO2+2NH3•H2O=2NH4++SO32-+H2O |
14.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 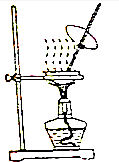 可用来蒸发FeCl3 溶液获得纯FeCl3 固体 | |
| B. |  可用向上排空气法收集CO2、NO 等气体 | |
| C. | 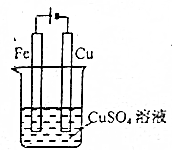 可以实现在铁棒上镀上一层铜 | |
| D. | 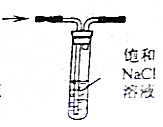 可以除去Cl2中混有的HCl |
18.下列有关能量的叙述不正确的是( )
| A. | 活化能的大小对化学反应前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+2 x283.0kJ/mol |
1.在理论上不能用于设计原电池的化学反应是 ( )
| A. | NaCl(aq)+AgNO3(aq)=AgCl(s)+NaNO3(aq )△H<0 | |
| B. | 2KMnO4(s)=2K2MnO4(s)+MnO2(s)+O2(g)△H>0 | |
| C. | 2FeCl3(aq)+Fe(s)=3FeCl3(aq)△H<0 | |
| D. | 2H2(g)+O2(g)=2H2O (l)△H<0 |